Questões de Concurso
Foram encontradas 1.400 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
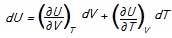
Assinale V para as afirmativas verdadeiras ou F para as falsas, considerando as derivadas parciais (∂U/∂V) e (∂U/∂T) na fórmula acima.
( ) A primeira derivada parcial é a chamada “pressão interna” e mede as interações.
( ) A segunda derivada parcial é a capacidade calorífica a volume constante.
( ) A derivada de (∂U/∂V), em relação à temperatura, é igual à derivada de (∂U/∂T), em relação ao volume.
A seqüência correta de preenchimento dos parênteses, de cima para baixo, é
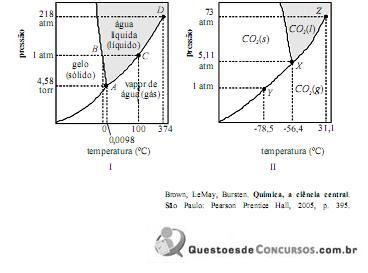
A partir das informações contidas nos diagramas I e II mostrados acima, cujas escalas não foram observadas, é correto afirmar que
 .
.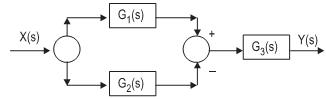
A função de transferência global entre Y(s) e X(s) é dada por
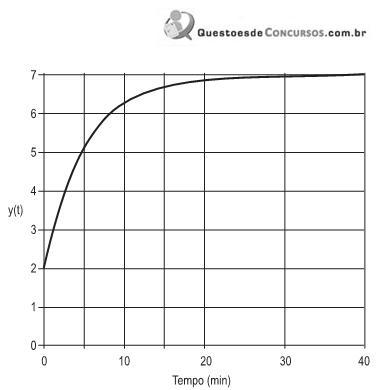
A figura acima representa a resposta da variável de saída y(t) a uma perturbação degrau de magnitude de 2 unidades na variável de entrada de um processo, a partir de um instante em que o processo estava em regime permanente. Com base nessas informações, a função de transferência desse processo é
I - A viscosidade de um fluido sempre diminui com o aumento da temperatura.
II - Fluidos nos quais a tensão de cisalhamento não é proporcional ao quadrado da taxa de deformação são ditos fluidos não newtonianos.
III - Um fluido plástico de Bingham não escoa quando submetido a uma tensão de cisalhamento inferior a um determinado valor limite.
IV - Há fluidos não newtonianos nos quais a viscosidade aparente varia com o tempo.
São corretas APENAS as proposições
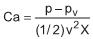
onde p é a pressão do fluido,
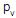 é a sua pressão de vapor, v é a velocidade de escoamento e a constante ½ não possui dimensão. Nesse caso, a dimensão de X é
é a sua pressão de vapor, v é a velocidade de escoamento e a constante ½ não possui dimensão. Nesse caso, a dimensão de X éConsiderando-se que sejam válidas as leis de Raoult e de Dalton e que as pressões de vapor dos hidrocarbonetos a 44 oC sejam: n-butano = 420 kPa e n-pentano = 132 kPa, o percentual molar de n-butano na mistura líquida é
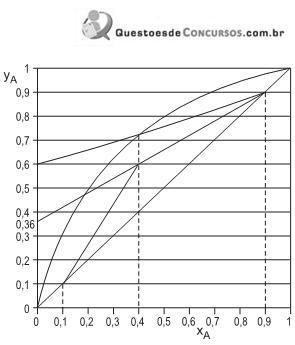
O gráfico
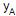 versus
versus 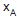 , apresentado acima, mostra as retas de operação usadas na montagem do diagrama de McCabe-Thiele, além de alguns pontos característicos. Com base nos dados apresentados no diagrama, conclui-se que a
, apresentado acima, mostra as retas de operação usadas na montagem do diagrama de McCabe-Thiele, além de alguns pontos característicos. Com base nos dados apresentados no diagrama, conclui-se que a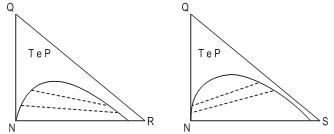
Os diagramas ternários acima representam o equilíbrio dos componentes N e Q com dois diferentes solventes, R e S. As linhas tracejadas correspondem às linhas de amarração (tie lines). Ao se comparar os diagramas apresentados e os dois solventes, conclui-se que o solvente R é
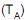 diminui, aumentando quando a temperatura da etapa isotérmica de rejeição de calor
diminui, aumentando quando a temperatura da etapa isotérmica de rejeição de calor 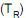 aumenta. Nesse contexto, a potência usada na compressão para a absorção de uma taxa de calor Q é representada pela seguinte expressão:
aumenta. Nesse contexto, a potência usada na compressão para a absorção de uma taxa de calor Q é representada pela seguinte expressão:

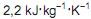 , e considerando-se a compressão como adiabática, o gás com comportamento ideal e as ineficiências associadas à máquina como nulas, a variação de temperatura entre a sucção e a descarga do compressor deve ser aproximadamente igual a
, e considerando-se a compressão como adiabática, o gás com comportamento ideal e as ineficiências associadas à máquina como nulas, a variação de temperatura entre a sucção e a descarga do compressor deve ser aproximadamente igual adh = Tds + vdp.
Usando uma das relações de Maxwell, a variação da entalpia com relação à pressão, mantendo-se a temperatura constante,
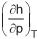 é determinada pela expressão
é determinada pela expressão