A partir das informações contidas nos diagramas I e II mostr...
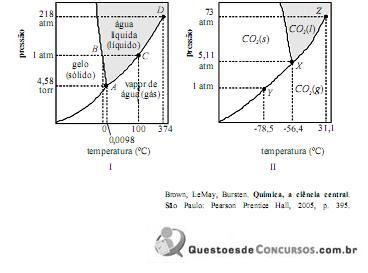
A partir das informações contidas nos diagramas I e II mostrados acima, cujas escalas não foram observadas, é correto afirmar que
Comentários
Veja os comentários dos nossos alunos
A letra B está errada pois:
No diagrama de fase para a água, vemos que a linha de equilíbrio sólido-líquido se inclina para a esquerda. Isto é uma consequência direta do fato de que a água líquida a 0 °C tem uma densidade maior que o sólido. O princípio de Le Châtelier requer que um aumento na pressão sobre um sistema em equilíbrio conduza a produção de fase de maior densidade, isto é, que um aumento na pressão favoreça a compactação das moléculas. Isto significa que, se tivermos água sólida e líquida em equilíbrio e aumentarmos a pressão, enquanto mantemos a temperatura em 0 °C, produziremos a fase líquida mais densa. No diagrama de fase, um aumento na pressão, a temperatura constante, implica movimento para cima ao longo de uma vertical. Podemos nos mover a partir da linha de equilíbrio sólido-líquido para cima, para uma região toda de líquido, somente se a linha sólido-líquido inclinar-se para a esquerda.
A água é uma substância incomum. Para quase todos os outros compostos, a fase sólida é mais densa que o líquido e, para estas substâncias, a linha sólido-líquido inclina-se para a direita.
Retirado de: http://infinito-e-diverso-els.blogspot.com.br/2014/10/diagrama-de-fases.html
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo