Questões de Concurso
Comentadas para técnico de laboratório - química
Foram encontradas 1.021 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A absorbância de uma amostra é definida como o inverso da fração de luz que passa por essa amostra.
Na titulação representada pela equação seguinte, o potencial no ponto de equivalência é igual à média aritmética dos potenciais padrão de redução dos dois pares redox envolvidos na reação.
U4+ + 2 Ce4+ + 2 H2O ⇌ UO2 2+ + 2 Ce3+ + 4 H+
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Para a determinação da concentração de Cu2+ em uma bebida supostamente contaminada, foi utilizada a volumetria de complexação com EDTA. O álcool de uma alíquota de 100 mL dessa bebida foi evaporado, e o volume novamente completado a 100 mL com água pura. Após ser tamponada a pH 10, essa alíquota de 100 mL foi titulada com 12,5 mL de EDTA 0,004 mol/L. O único metal presente na amostra era o cobre, cuja massa molar é de 63,55 g/mol. Assertiva: Nessa situação, a concentração de cobre na bebida é maior que 25 mg/L.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
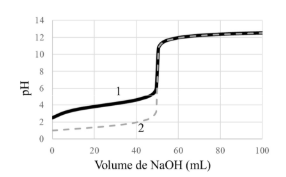
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.