Questões de Concurso
Foram encontradas 7.137 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O Regulamento Técnico SVS/MS nº 540/1997 considera o fermento químico como um aditivo, e como tal, necessita obrigatoriamente ser registrado na ANVISA de acordo com as orientações da Resolução nº 23 (ANVISA, 2000).
Basicamente, os fermentos químicos são constituídos de uma mistura de pirofosfato ácido de sódio, bicarbonato de sódio e fécula de mandioca. Além do conhecido bicarbonato de sódio, assinale a alternativa que apresente alguns ácidos que podem fazer parte da composição.
I. As ligações químicas nos compostos orgânicos podem ser do tipo s ou p . A ligação s é formada pela interação de dois orbitais atômicos, segundo o eixo que une os dois átomos, ao passo que na ligação p, a interação dos orbitais atômicos se faz segundo o plano que contém o eixo da ligação.
II Neste composto orgânico podemos encontrar 2 ligações s e 6 ligações p.
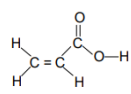
III. Neste composto orgânico podemos encontrar 3 ligações s e 6 ligações p.
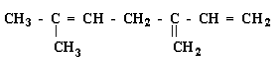
Estão corretas as afirmativas:
( ) É um tipo particular de ligação entre moléculas que possuem átomos de hidrogênio ligados a átomos de flúor, oxigênio ou nitrogênio.
( ) Nas pontes de hidrogênio, os elementos são muito eletronegativos e possuem pequenos raios atômicos, neste caso, fazendo com que o par de elétrons fique muito atraído pelo elemento mais eletronegativo, gerando dipolos (+) e (-) bastante intensos.
( ) As moléculas H2O ; NH3 ; HF são exemplos de ligações com formação de pontes de hidrogênio.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. Sabemos que as moléculas polares são aquelas que têm regiões ou polos de carga elétricas diferentes. Isto pode ser explicado pela diferença de eletronegatividade entre os ligantes. Costuma-se afirmar que as moléculas assimétricas são polares e que as moléculas simétricas são apolares, quando se refere justamente a de densidade eletrônica.
PORQUE
II. Elementos diferentes têm, geralmente, eletronegatividades diferentes, com isso, haverá regiões de densidades eletrônicas diferentes que não serão compensadas umas pelas outras.
Assinale a alternativa correta.
Em relação aos elementos químicos mencionados anteriormente, analise as afirmativas abaixo. ]
I. Os ametais citados pertencem ao grupo dos calcogênios e ao grupo dos halogênios, possuindo seis e sete elétrons no subnível mais energético respectivamente.
II. Todos os metais citados pertencem ao quarto período da classificação periódica e possuem elétrons distribuídos em quatro camadas eletrônicas.
III. Existem na relação acima dois ametais que apresentam propriedades semelhantes às do oxigênio, pois possuem o mesmo número de elétrons na camada de valência.
IV. Todos os metais citados são elementos de transição e apresentam na camada de valência elétrons distribuídos no subnível d.
Estão corretas as afirmativas:
I. Alta temperatura de fusão e ebulição.
II. Boa condutividade elétrica em solução aquosa.
III. Mau condutor de eletricidade no estado sólido.
IV. Com exceção do grafite, não conduzem corrente elétrica, se encontrados puros.
Estão corretas as afirmativas:
( ) Sommerfeld propõe que a energia do elétron seria determinada pela distância em que ele se encontra do núcleo e pelo tipo de órbita que descreve.
( ) Hantaro Nagaoka, em 1903, sugeriu um modelo atômico formado por pares de cargas positivas e negativas, aos quais chamou de “dinamidas”. E estes pares de cargas ficariam em blocos flutuantes no espaço.
( ) Em 1904, Philipp Lénard publicou no Japão uma descrição do carbono, bem moderna para época, ele sugeriu que o átomo era constituído de um anel de elétrons ao redor de um centro muito denso.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. O físico inglês J. J. Thomson, em 1887, mostrou que as partículas em raio catódico são carregadas negativamente e ele provou esta afirmação mostrando que o raio pode ser desviado se passar entre placas de metais carregados opostamente em um tudo de Crookes. Segundo suas pesquisas, a direção do desvio para a placa carregada positivamente, mostra que as partículas do raio catódico carregam uma carga elétrica negativa.
II. Segundo os pesquisadores dos modelos atômicos, foi no ano de 1908, que Robert Millikan, um físico americano realizou, um clássico experimento, que foi capaz de determinar a magnitude da carga negativa do elétron. Millikan acreditava que os raios x chocavam-se com os elétrons das moléculas do ar que circundavam as gotículas de óleo e que as gotículas poderiam captar estes elétrons. Através de seus experimentos, Milikan foi assim capaz de mostrar que todos os elétrons são idênticos, isto é, todos têm a mesma massa e carga.
III. Embora para a maioria dos cientistas da época o fato do átomo ser constituído por uma parte carregada positivamente e por alguns elétrons, em 1890, isto ainda não era totalmente claro. Em 1898, que J. J. Thomson sugeriu que um átomo poderia ser uma esfera carregada positivamente na qual alguns elétrons estão incrustados. Segundo ele, isto levaria a uma impossível remoção de elétrons dos átomos.
Estão corretas as afirmativas:
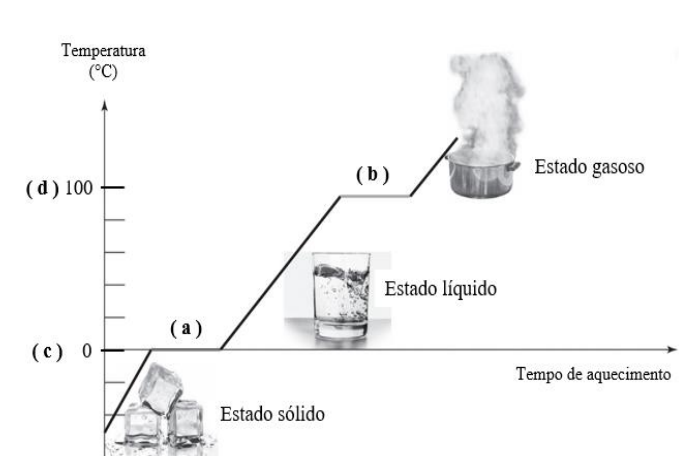
De acordo com as afirmativas a seguir:
I - o ponto (a) se refere ao estado e ebulição da água II - o ponto de fusão ocorre a 100°C. III - entre o estado líquido e o estado gasoso (b) ocorre o ponto de ebulição da água.
É incorreto o que se afirma em:
Gregos teriam decorado seus vasos funerários com gesso, revela estudo
“Um estudo realizado por pesquisadores da Universidade de Palermo, localizada na Itália, descobriu que os antigos gregos teriam usado gesso para fazer algumas das pinturas presentes em seus vasos funerários (...). Eles puderam identificar sulfato de cálcio (origem do gesso) nas figuras brancas presentes em vasos de fundo preto ou vermelho, o que lhes permitiu entender melhor o processo de desenvolvimento desses objetos artísticos”. (Adaptado)”
Fonte: https://aventurasnahistoria.uol.com.br/noticias/historia-hoje/gregosteriam-decorado-seus-vasos-funerarios-com-gesso-revela-estudo.phtml. Acesso em 10/01/2023
A fórmula molecular da substância química identificada nas figuras dos vasos funerários é:
Dia da Vodka: descubra algumas informações interessantes sobre a bebida
“No dia 04 de outubro se comemora o Dia da Vodka. A Vodka é uma popular bebida destilada que caiu nas graças de quem aprecia um drink ... Como surgiu a Vodka? Foi no ano de 1865, na Rússia, que o renomado cientista Dmitri Ivanovich Mendeleev decidiu misturar álcool e água em diferentes proporções durante um ano. Depois de várias experiências, ele encontrou aquilo que seria o ideal: 40% de álcool e 60% de água”. (Adaptado)
Fonte: https://www.segs.com.br/demais/313189-dia-da-vodka-descubra-algumasinformacoes-interessantes-sobre-abebida#:~:text=No%20dia%2004%20de%20outubro,ela%20%C3%A9%20capaz %20de%20oferecer. Acesso em 09/01/2023
O renomado cientista russo citado na reportagem também foi o responsável pela criação de um dos mais importantes trabalhos da Ciência mundial denominado:
A importante etapa de tratamento da água descrita no texto é denominada:
I. Os produtos químicos que necessitam de cuidados em sua estocagem são apenas os gasosos, especialmente os de alta toxicidade.
II. Os solventes inflamáveis devem ser aquecidos em banho-maria ou em uma manta elétrica e jamais à chama do bico de Bunsen.
III. Os acidentes de laboratório, envolvendo substâncias tóxicas, ocorrem, em sua maioria, por inalação, embora também possam ocorrer por absorção, através da pele.
IV. A temperatura de fulgor de um líquido é a temperatura máxima, à qual a pressão de vapor é suficiente para iniciar a inflamação do líquido em presença da chama.
São VERDADEIRAS