Questões de Concurso
Foram encontradas 3.121 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O tipo de armário descrito em II está em conformidade com os requisitos de segurança, pois minimiza a liberação de vapores tóxicos para a área do laboratório.
Para padronizar a solução titulante citada em III, é adequado o uso do dicromato de potássio como padrão primário.
Na cromatografia líquida, em uma separação por partição de fase normal, o soluto menos polar passa proporcionalmente mais tempo na fase estacionária e é o último soluto a eluir da coluna.
Acerca das cromatografias líquida e gasosa e da espectrometria de massa, julgue o próximo item.
Na cromatografia de gás, a fase móvel interage com as
moléculas do analito e, por isso, o gás da fase móvel deve
apresentar alta reatividade e ser escolhido de acordo com as
características do analito.
A diferença entre a espectrometria de absorção atômica (AAS) e a espectrometria de emissão atômica por plasma acoplado indutivamente (ICP-AES) é que a AAS é capaz de quantificar a maioria dos ânions e dos metais, enquanto a ICP-AES é inapropriada para dosagem de ânions.
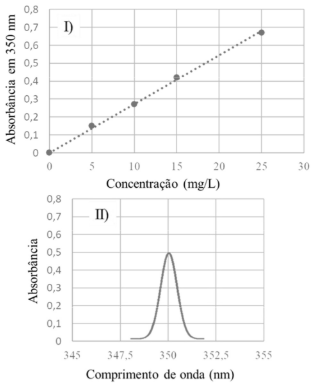
Considerando-se o gráfico I, que mostra a curva de calibração obtida a partir da leitura da absorbância de determinado analito a 350 nm em diferentes concentrações, e o gráfico II, que ilustra o espectro obtido para uma amostra desse analito nas mesmas condições experimentais usadas para a construção da curva de calibração, é correto afirmar que a concentração do analito na amostra é maior que 15 mg/L.
Situação hipotética: A absortividade molar de um analito é igual a 500,0 mol • cm−1 • L−1 quando medida a uma concentração igual a 1,0 × 10−3 mol/L em um espectofotômetro de absorção no ultravioleta visível, em determinado comprimento de onda. Assertiva: Nas mesmas condições experimentais, para que a absorbância seja igual a 0,4, o caminho óptico da cubeta contendo o analito deverá ser maior que 1,0 cm.
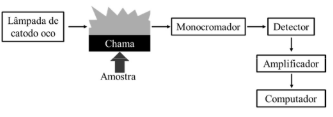
O esquema a seguir representa corretamente a montagem de um fotômetro de chama.
A absorbância de uma amostra é definida como o inverso da fração de luz que passa por essa amostra.
Na titulação representada pela equação seguinte, o potencial no ponto de equivalência é igual à média aritmética dos potenciais padrão de redução dos dois pares redox envolvidos na reação.
U4+ + 2 Ce4+ + 2 H2O ⇌ UO2 2+ + 2 Ce3+ + 4 H+
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Para a determinação da concentração de Cu2+ em uma bebida supostamente contaminada, foi utilizada a volumetria de complexação com EDTA. O álcool de uma alíquota de 100 mL dessa bebida foi evaporado, e o volume novamente completado a 100 mL com água pura. Após ser tamponada a pH 10, essa alíquota de 100 mL foi titulada com 12,5 mL de EDTA 0,004 mol/L. O único metal presente na amostra era o cobre, cuja massa molar é de 63,55 g/mol. Assertiva: Nessa situação, a concentração de cobre na bebida é maior que 25 mg/L.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
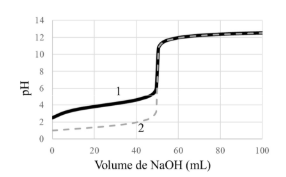
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
Na titulação de um ácido monoprótico cuja constante de dissociação ácida seja Ka = 1 × 10−4, o indicador ácido-base escolhido terá o melhor rendimento se tiver pKa = 4.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.
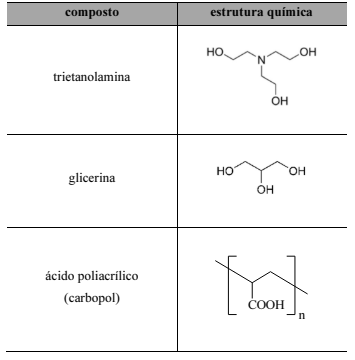
O carbopol, representado na tabela, pode ser obtido a partir da polimerização do ácido prop-2-enoico.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.

A nomenclatura oficial da glicerina é propano-1,2,3-triol.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.

Em solução fortemente ácida, os grupos carboxila do carbopol encontram-se majoritariamente ionizados.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.

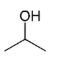
A estrutura química do álcool isopropílico é a seguinte.
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
É correto concluir que a massa de propano necessária para fornecer 350 kJ é superior a 7 g.
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
A entalpia de formação do propano pode ser obtida pela diferença entre ΔHc° e a soma das entalpias padrão de formação dos produtos da reação de combustão mostrada.