Questões de Concurso
Para cetem
Foram encontradas 40 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A solução de ácido sulfúrico é muito utilizada em controle de qualidade em indústrias. Em uma determinada indústria solicitaram ao técnico do turno C para preparar 1 L de uma solução de ácido sulfúrico com concentração igual a 1 M devidamente padronizada.
Dados: MM (H₂SO₄): 98,00 g mol-1; densidade (H₂SO₄): 1,84 g/mL; Pureza: 98%
Em relação ao volume correto que o técnico necessita mensurar de ácido sulfúrico para atender à demanda solicitada e o padrão mais adequado para realizar a padronização da solução preparada, assinale a alternativa correta.
Uma amostra de ácido acético (CH3COOH) é dissolvida em água e estabelece-se um equilíbrio químico com seus íons correspondentes. Considere a equação química:
CH3COOH(aq) ⇌ CH3COO- (aq) + H+(aq)
Qual dos seguintes fatores afetará diretamente a posição do equilíbrio?
Um pesquisador solicitou a um técnico que preparasse soluções de sais de sódio utilizando os ácidos listados na tabela a seguir com uma concentração inicial de 0,500 M.
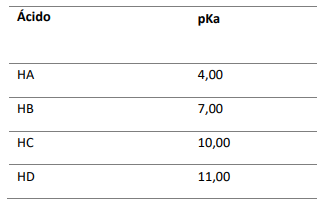
Nessa situação, a solução que terá o pH mais alto e será a mais básica é(são)
Durante uma série de análises utilizando ICP-OES para determinar a concentração de elementos em amostras de água de diferentes fontes, um pesquisador observou um aumento inesperado na intensidade do sinal de cálcio em uma das amostras coletadas em uma área específica. Os resultados mostraram que a concentração de cálcio nessa amostra era significativamente maior do que nas outras amostras da mesma região. Com base nesses dados, qual das seguintes opções poderia explicar esse fenômeno?
Muitas indústrias utilizam caldeiras a vapor, onde ocorrem vários problemas de obstruções devido à qualidade da água. Portanto, um dos parâmetros de controle de qualidade é a dureza da água. Um operador de indústria que processa celulose coletou uma amostra de água da caldeira e enviou ao laboratório de águas para determinação do teor de cálcio em ppm. O analista utilizou 15 mL da amostra de água, 50 mL de Eriocromo T, utilizou um tampão para chegar ao pH 10; na titulação ele gastou 5,9 mL de solução padrão de EDTA 0,02 M.
Assinale a alternativa que apresente corretamente o valor obtido de dureza da amostra de água por meio do teor de cálcio em mg/mL.
A concentração de FeCl₂ em solução aquosa foi determinada por titulação redox com solução de K2Cr2O7 0,170 M. A amostra foi primeiro dissolvida em HCl para tornar a solução ácida. A equação iônica líquida balanceada para a reação que ocorre no decorrer da titulação é:
Cr2O72– (aq) + 6 Fe2+(aq) + 14 H+ (aq) →
2 Cr3+(aq) + 6 Fe3+(aq) + 7 H2O(l)
Os volumes na bureta e no frasco são iguais.
Assinale a alternativa que indique corretamente a concentração de FeCl₂ na solução e a porcentagem de Cr2O72–que deve ser adicionada para reagir com todos os íons Fe2+, respectivamente.
A titulação de um ácido forte e uma base fraca pode ser ilustrado pela reação do HCl e NH₄OH, conforme representada abaixo:
HCl + NH₄OH ⇄ NH₄Cl + H₂O
Assinale a alternativa que apresente corretamente o indicador mais apropriado para a titulação.
A concentração de íon sulfato em água natural pode ser determinado medindo-se a turbidez que resulta quando um excesso de BaCl₂ é adicionado a uma quantidade determinada de amostra. Um turbidímetro, o instrumento usado para esta análise, foi calibrado com uma série de soluções padrão de Na₂SO₄. Os dados que seguem forma obtidos na calibração:
|
ppm de |
Leitura do turbidímetro, R |
0,00 |
1,96 |
5,00 |
1,91 |
10,00 |
1,88 |
15,0 |
1,94 |
Com base na tabela, considerando os dados da leitura do turbidímetro, à média, o desvio-padrão absoluto e o coeficiente de variação para os dados, são, respectivamente,
O ato de medir é, em essência, um ato de comparar, e essa comparação envolve erros de diversas origens (instrumentais, pessoais, metodológicos, entre outros). O erro está sempre presente em qualquer medida. Não existe uma medida perfeita.
A respeito dos erros de medição, analise as afirmativas a seguir:
I. Os erros sistemáticos têm um valor definido, têm uma causa determinável e são de mesmo sinal e magnitude para cada repetição da medida realizada do mesmo modo.
II. Os erros metodológicos são frequentemente introduzidos pelo comportamento não ideal, físico e químico dos reagentes e das reações nas quais a análise está baseada. São mais fáceis de detectar e corrigir que os erros pessoais e instrumentais.
III. Os erros pessoais são aqueles introduzidos em uma medida pelas apreciações do experimentador e pelas decisões que ele deve tomar.
IV. Os erros instrumentais são facilmente detectáveis e corrigidos por calibração com padrões adequados e levam ao que chamamos de tendência de uma técnica de medida.
É correto o que se afirma somente em
O ICP-OES (Espectrometria de Emissão Ótica com Plasma Indutivamente Acoplado) e o ICP-MS (Espectrometria de Massas com Plasma Indutivamente Acoplado) são duas técnicas analíticas para a determinação de metais que permitem a detecção simultânea de vários elementos com limites de detecção e quantificação bastante baixos, atingindo até a ordem de “partes por trilhão”. Em relação às técnicas, avalie as afirmativas a seguir e a relação proposta entre elas.
I. Ambas as técnicas usam um plasma como fonte de energia para desestabilizar a configuração eletrônica dos átomos presentes na amostra.
II. Os limites de detecção obtidos para técnica de ICP-MS são inferiores aos obtidos pela técnica de ICP-OES.
III. A técnica de ICP-MS tem baixa tolerância a sólidos dissolvidos, em comparação a técnica de ICP-OES.
IV. Ambas as técnicas o plasma atua como uma fonte de íons, não de radiação emitida.
É correto ao que se afirma somente em
A gravimetria convencional, também conhecida como gravimetria de precipitação, consiste em uma sequência de operações que tem como objetivo precipitar (separar) a substância de interesse (o analito) na forma de um composto pouco solúvel, com estequiometria conhecida e bem definida. É um método de análise em que o sinal medido é a massa ou a variação de massa e sua aplicação requer apenas o uso de unidades básicas do Sistema Internacional de Unidades (SI), como a massa ou o mol.
(ANDRADE, J. C. Química analítica básica: análise gravimétrica convencional. Revista Chemkeys, Campinas, SP, v. 4, n. 00, p. e022004, 2022.)
A porcentagem em massa de chumbo no minério original, na amostra, é
Durante uma análise espectroscópica de absorção molecular no UV/Vis, um pesquisador estava investigando a concentração de uma solução de um corante desconhecido. Ele preparou soluções de concentrações conhecidas do corante e registrou os espectros de absorção para cada uma delas. Após analisar os dados, ele observou que a relação entre absorbância e concentração não era linear. Em vez disso, ele notou um aumento exponencial na absorbância com o aumento da concentração.
Tomando como base a interação do corante com a luz na faixa do UV/Vis, assinale a alternativa correta.
A espectrometria de emissão ótica com plasma indutivamente acoplado (ICP-OES) é uma técnica multielementar bem estabelecida e econômica, usada rotineiramente para análises geoquímicas na indústria de exploração mineral. Os sistemas disponíveis variam desde instrumentos simultâneos relativamente caros, capazes de determinar com precisão e exatidão mais de 35 elementos principais e traços em menos de 2 minutos, até máquinas sequenciais muito mais baratas e mais lentas, que competem diretamente com espectrômetros de absorção atômica.
(Disponível em: JARVIS, I.; JARVIS, K. E. Inductively coupled plasma-atomic emission spectrometry in exploration geochemistry. Journal of Geochemical Exploration, Vol. 44, Issues 1–3, p. 139-200, July 1992 - tradução livre.)
Considerando a função do gás nebulizante na ICP-OES, assinale a alternativa correta.
O produto de solubilidade dos compostos é de grande importância na química analítica, pois, com seu auxílio, é possível não só explicar como também prever as reações de precipitação. Ele também tem importantes aplicações no tratamento de esgoto sanitário, na extração de minerais da água do mar, na formação e perda de ossos e dentes e no ciclo global do carbono.
(ATKINS, P.W.; JONES, L. Princípios de química – Questionando a vida moderna e o meio ambiente, 5ª Edição, 2011.)
A respeito do produto de solubilidade, analise as afirmativas a seguir:
I. A constante do equilíbrio entre um sólido e seus íons dissolvidos é chamada de produto de solubilidade, Kps, do soluto.
II. A constante do produto de solubilidade, Kps para uma solução saturada de Ca(IO3)2 em água é Kps= [Ca+2][IO-3].
III. O produto de solubilidade Kps para o sal de prata AgX é 4,0 x 10-8. A solubilidade molar do AgX em água é 2,0 x 10-4 mol L-1.
IV. A comparação dos valores de Kps não pode ser usada para prever a ordem de precipitação de sais que apresentam a mesma proporção estequiometria entre cátion e ânion.
Está correto apenas o que se afirma em
Na determinação de Fe(II) e Cu(I) em uma amostra aquosa, empregou-se uma solução de 1,10-fenantrolina, em uma solução tamponada em pH 4,5. Os complexos formados com Fe(II) e Cu(I) apresentaram absorções máximas em 511 e 371 nm, respectivamente. Observou-se que a determinação de ferro em 511 nm é isenta da interferência de cobre; entretanto, em 371 nm ambos os complexos metálicos apresentam absorção. Para a amostra analisada, a absorbância medida a 371 nm foi 0,600 e a 511 nm a absorbância foi 0,350. A concentração de Fe(II) e Cu(I) em mg/L, na amostra é, respectivamente,
Dados: Cela de 10 mm de caminho óptico.
Complexo |
Absortividade Molar(L.mg-1.cm-1) |
|
371 nm |
511 nm |
|
Fe (II) |
0,019 |
0,297 |
Cu (I) |
0,190 |
0 |
Durante um experimento de química analítica, um estudante realizou cinco determinações consecutivas da concentração de íons em uma solução padrão, obtendo os seguintes resultados em mol/L: 2,32; 2,41; 2,39; 2,45; 2,59. A equação da reta para esses dados é mostrada a seguir:
y = 0,058x + 2,258
Sabendo que a Soma Total dos Quadrados (SST) é igual a 0,04 e a Soma dos Quadrados dos Erros (SSE) é igual a 0,006, é correto afirmar que o coeficiente de determinação — R2 — é igual a
A validação de um método é um dos elementos básicos em sistemas de qualidade e que integra os programas de Boas Práticas de Laboratório – BPL. Para tanto, os procedimentos analíticos podem ser atestados pela determinação de parâmetros conhecidos como figuras de mérito. Esses parâmetros, dependendo de onde o método será aplicado, do seu propósito e/ou do órgão de fiscalização a que estará sujeito podem variar, sendo as principais: exatidão, precisão, sensibilidade, seletividade, linearidade, razão sinal/ruído, limite de detecção, robustez, intervalos de confiança, teste para erros sistemáticos, extensão da faixa de trabalho ou faixa dinâmica.
Acerca das figuras de mérito, é incorreto afirmar que
Um pesquisador está analisando uma amostra sólida de mineral utilizando a técnica de ablação a laser conjugada a um espectrômetro de massa (LA-ICP-MS). Ele ajustou os parâmetros do laser para uma energia de ablação mais alta. De acordo com o impacto que provavelmente acarretará nos resultados da análise mediante o aumento na energia do laser, é correto afirmar que
A drenagem ácida de rocha (DAR) é uma atividade geradora de grandes volumes de efluentes contendo sulfato, que está associada à oxidação natural de minerais sulfetados contidos em rochas quando expostas à ação do ar e da água. Segundo a Organização Mundial da Saúde, o teor recomendável para a concentração de sulfato em água potável deve ser inferior a 500 mg/L. Já a United States Environmental Protection Agency (USEPA) determina um teor inferior a 250 mg/L. Assim, muitos países recomendam uma faixa entre 250 a 500 mg/L de sulfato como limite máximo em efluentes e em águas para diversos usos, humanos e animais. A gravimetria por precipitação é uma técnica analítica de referência para a determinação do teor de sulfato em amostras de água pela adição de solução de cloreto de bário.
(Disponível em: Ferreira, B. C. S., Lima, R. M. F., & Leão, V. A. (2011). Remoção de sulfato de efluentes industriais por precipitação. Engenharia Sanitária e Ambiental, 16(4), 361–368. https://doi.org/10.1590/S1413-41522011000400007)
Sobre esse procedimento, analise as afirmativas a seguir:
I. É aconselhável fazer a precipitação em solução fracamente ácida.
II. A calcinação final do sulfato de bário não precisa ser feita a uma temperatura superior a 800°C.
III. É importante fazer a precipitação acima da temperatura de ebulição.
IV. O precipitado deve ser lavado com água fria.
Está correto apenas o que se afirma em
“A base da análise gravimétrica é a pesagem de uma substância obtida pela precipitação de uma solução, ou volatizada e subsequentemente absorvida.” (MENDHAM, J. et al. VOGEL, Análise Química Quantitativa. 6. ed. RIO DE JANEIRO: LTC, 2002.)
Considerando os princípios que determinam o sucesso de uma análise por precipitação, assinale a afirmativa incorreta.