Questões de Concurso
Para petrobras
Foram encontradas 22.502 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Julgue o item subsequente, relativo a reações orgânicas e a aspectos pertinentes a isomeria.
A acetona e o propanal são isômeros funcionais.
Acerca de reações inorgânicas, julgue o item que se segue.
A reação 2 NaCl + I2 → 2 NaI + Cl2 ocorre espontaneamente.
Acerca de reações inorgânicas, julgue o item que se segue.
A reação 2 NaN3 → 2 Na + 3 N2 representa um processo de
síntese.
Acerca de reações inorgânicas, julgue o item que se segue.
A reação Ca(NO3)2 + Na2CO3 → CaCO3 + 2 NaNO3 é do
tipo dupla troca.
Com referência a funções orgânicas, julgue o item que se segue.
Enóis são funções orgânicas formadas por uma hidroxila
ligada a um carbono sp3
.
Com referência a funções orgânicas, julgue o item que se segue.
A molécula cuja fórmula estrutural é mostrada a seguir apresenta a funcionalidade de anidrido.
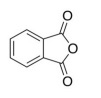
Com referência a funções orgânicas, julgue o item que se segue.
O grupo dos hidrocarbonetos inclui o subgrupo dos ciclanos,
cuja fórmula geral é CnH2n+2.
Com referência a funções orgânicas, julgue o item que se segue.
O composto 3-buten-1-ol corresponde à seguinte fórmula estrutural.
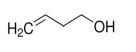
Com referência a funções orgânicas, julgue o item que se segue.
Considerando que a fórmula estrutural a seguir corresponde à molécula de paracetamol, é correto concluir que, no paracetamol, estão presentes as funções orgânicas amina e fenol.
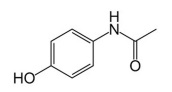
Com base nessa reação química, julgue o próximo item.
O Ca(HCO3)2 é o carbonato de cálcio.
Com base nessa reação química, julgue o próximo item.
Participam da reação três óxidos e dois sais.
Com relação a essa situação hipotética, julgue o item seguinte, considerando que todos os gases se comportem idealmente, que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se, às 18 h, a temperatura ambiente, em equilíbrio térmico
com o gás, alcançar 30 °C, então, nessa nova situação, a
pressão de gases no tanque será superior a 22 MPa.
Com relação a essa situação hipotética, julgue o item seguinte, considerando que todos os gases se comportem idealmente, que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se o referido GNV for totalmente transferido para outro
botijão à mesma temperatura e, nesse novo botijão, a pressão
final dos gases for de 30 MPa, então o volume gasoso desse
novo botijão será de 10 m3
.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Supondo que todo o oxigênio produzido na eletrólise seja
lançado na atmosfera, então, a 1 atm de pressão e 298 K de
temperatura, uma tonelada de água submetida à eletrólise
lançará mais de 500.000 L de oxigênio na atmosfera.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Uma tonelada de água produzirá menos de 120 kg de
hidrogênio em uma eletrólise.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
O oxigênio (O) e o fósforo (P) pertencem ao mesmo grupo
da tabela periódica.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Segundo a classificação periódica dos elementos, o
hidrogênio é considerado um metal alcalino.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
A reação de eletrólise da água é incompatível com o modelo
atômico de Dalton, segundo o qual, em uma reação química,
os átomos são alterados, pois as propriedades das substâncias
são alteradas.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Se a fração molar de metano (CH4) no gás natural for igual
a 70%, então, em um botijão de gás natural sob a pressão
de 680 kPa, a pressão parcial do metano será superior
a 500 kPa.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
A pressão da mistura de hidrogênio e gás natural será igual à
soma da pressão parcial do hidrogênio e das pressões
parciais dos gases que compuserem o gás natural.