Questões de Concurso
Para if-sc
Foram encontradas 3.261 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. O método mais comum para determinar o ponto final de uma titulação complexométrica é o uso de um indicador metalocrômico.
II. O ácido etilenodiaminotetracético (EDTA) é um ligante hexadentado muito utilizado para titulações complexométricas.
III. Uma característica do EDTA é sua forte ligação com íons metálicos e o fato de que o produto dessa reação é um complexo na proporção de 1:4.
IV. Uma solução padrão preparada dissolvendo-se uma quantidade conhecida de CaCO3 pode ser usada para padronizar uma solução de EDTA para a titulação de Ca2+ na análise da dureza da água.
V. Um agente mascarante é o complexante que reage seletivamente com um componente da solução para impedir que este último interfira na determinação.
Quais estão corretas?
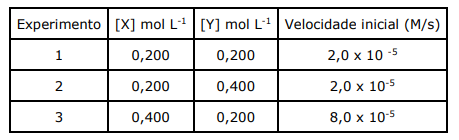
Com base nos dados da tabela, analise as assertivas abaixo:
I. A lei de velocidade para a reação é v= k [X]2 .
II. A concentração de Y não tem nenhum efeito sobre a velocidade da reação.
III. A ordem global da reação é 3.
IV. A constante de velocidade da reação é 2,0 x 10-3 M-1s-1.
Quais estão corretas?
Coluna 1
1.
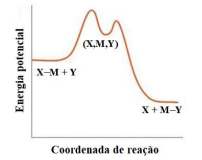
2.
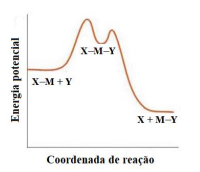
3.
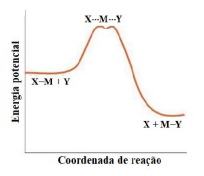
Coluna 2 ( ) Mecanismo dissociativo. ( ) Mecanismo associativo. ( ) Mecanismo de troca.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
( ) O estágio não deve ser considerado como um momento de aprendizagem e construção da identidade profissional docente.
( ) Para que o estágio tenha resultado positivo, as atividades devem ser programadas a fim de que não se afastem da realidade.
( ) A prática de ensino não deve ser amparada pelo estágio supervisionado, somente assim o futuro docente terá sua construção da identidade profissional ou a transformação de sua profissão.
( ) O estágio como construção do saber e a construção da identidade profissional é uma oportunidade de refletir sobre a teoria e pensar dialeticamente a prática.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
I. De acordo com a teoria atômica de Dalton, os átomos são permanentes e indivisíveis, eles não podem ser criados nem destruídos.
II. Thomson propôs que o átomo é constituído de uma esfera positiva grande e difusa, na qual os elétrons eram encaixados.
III. Bohr usou o tubo de raios catódicos e seu conhecimento da teoria eletromagnética para determinar a razão entre a carga elétrica e a massa de um elétron.
IV. O modelo atômico de Rutherford representa o átomo consistindo em um pequeno núcleo, que contém toda a carga positiva e quase toda a massa do átomo, rodeado pelos elétrons.
Quais estão INCORRETAS?
Calcule a variação de entalpia quando 72 g de gelo se fundem.
Considere: ΔH fus= 6009,5 J/mol
( ) Átomos que compartilham elétrons para preencher camadas de valência formam ligações covalentes.
( ) As ligações covalentes são classificadas em duas categorias, polares e apolares, dependendo da diferença de eletronegatividade entre os átomos ligados.
( ) Os átomos de elementos com eletronegatividades muito diferentes tendem a formar entre si ligações covalentes.
( ) Na formação do NaCl a partir dos átomos de sódio e cloro, um elétron é transferido da camada de valência do sódio para a camada de valência do cloro.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
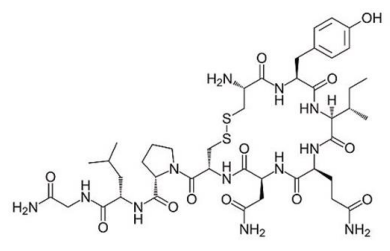
( ) Proteínas são moléculas constituídas de vários aminoácidos, ligados através de ligações peptídicas.
( ) Aminoácidos são compostos orgânicos que contêm um grupo amina e um grupo carboxila.
( ) As propriedades das proteínas são baseadas nas propriedades da cadeia peptídica e das cadeias laterais.
( ) Vários hormônios são proteínas, como a insulina e o hormônio do crescimento humano.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é: