Questões de Concurso
Para if-to
Foram encontradas 3.140 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. DIMSTYLE: comando que permite criar ou modificar um estilo de cota. II. ERASE: comando que permite apagar objetos. III. MEASURE: comando usado para definir o limite máximo de um desenho. IV. PURGE: comando usado para remover os dados desnecessários do desenho. V. SCALE: comando usado para definir o limite máximo de um desenho.
Analise as afirmativas dadas e assinale a opção correta.
A figura abaixo representa um atuador pneumático de movimento retilíneo de dupla ação e um sensor de início e outro de fim de curso. O circuito de comando elétrico não envolve dispositivos eletrónicos e nem equipamentos de mesma natureza.
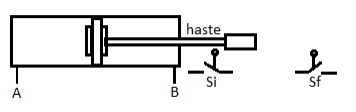
Assinale a alternativa correta.
Uma pressão de 30 lbf/pol2 (30 PSI) corresponde nas unidades Pascal, kgf/cm2 e atm, aos valores respetivamente anotados nas alternativas abaixo.
Assinale a alternativa correta.
Identifique as técnicas clássicas descritas abaixo, respectivamente:
I. Identificação de íons metálicos por meio da cor da chama.
II. Quantificação da concentração de uma substância por meio da adição controlada e quantificada de outra substância reativa de concentração conhecida.
III. Separação e identificação de substâncias pela diferença da temperatura de ebulição dos constituintes.
IV. O analito é convertido numa substância pouco solúvel. O precipitado é filtrado e lavado para remoção de impurezas e convertido, quando necessário, geralmente por meio de um tratamento térmico adequado, em um produto de composição química conhecida. O produto é então pesado.
Alguns procedimentos de laboratório podem parecer simples, porém para que sejam feitos de maneira correta e segura faz-se necessário ter atenção a uma série de detalhes.
Um professor orienta para que os estudantes façam
100 mL de uma solução de NaOH 0,01 mol/L.
Faça os cálculos previamente, tendo atenção na pureza do reagente.
Pese rapidamente a quantidade calculada de
hidróxido de sódio em lentilhas em um béquer,
evitando que o frasco do reagente fique aberto por
muito tempo.
Adicione em torno de 50mL de água destilada no béquer com NaOH, dissolva bem e espere esfriar. Transfira para o balão volumétrico de 100mL utilizando funil, adicione pequenas alíquotas de água destilada no béquer transferindo-as para balão através do funil de forma que o volume não seja completo.
Adicione água destilada até que o menisco fique
próximo da marca de aferição. Faça a aferição do
menisco gotejando com pipeta de Pasteur. Tampe o
balão, faça a homogeneização.
Sobre as instruções do professor, é correto afirmar, exceto:
O trabalho em um laboratório envolve necessariamente um grau de risco; acidentes podem acontecer e acontecem. A adoção rigorosa das normas contribui na prevenção (ou minimização dos efeitos) de acidentes.
Analise as possíveis situações que podem ocorrer e analise as ações tomadas.
I. Uma estudante derramou uma quantidade considerável de ácido acético glacial em sua blusa. No socorro, ela deve ter sua intimidade preservada, portanto deve-se encaminhar a estudante para um banheiro feminino mais próximo para enxágue com água corrente e posteriormente à sala do médico ou enfermeiro da unidade.
II. Para qualquer tipo de acidente, faz-se
necessário procurar o responsável técnico ou
comissão de saúde e segurança do trabalho da
instituição para que as ações de socorro
possam ser executadas conforme o padrão da
instituição.
III. Usuários do laboratório de química que utilizam lentes de contato só podem executar ou acompanhar experimentos se fizerem o uso de óculos de proteção.
IV. No laboratório não se deve levar comida ou bebida. Não tomar líquidos em recipientes de vidro de laboratório. Não fumar no laboratório.
Das situações apresentadas acima, estão corretas:
Tendo por base a BNCC, analise as afirmações a seguir, sobre o currículo de química no ensino médio.
I. A construção dos currículos de química das escolas brasileiras passa a ser pautada no desenvolvimento de competências, tendo como referência a Base Nacional Curricular Comum.
II. Com a aprovação da BNCC, os conteúdos de química ministrados nas escolas brasileiras passam a ter uniformidade, garantindo que todos os estudantes possam desenvolver o aprendizado de maneira igualitária, independentemente de sua região ou situação econômica.
III. A inserção dos Itinerários Formativos, inclusive da formação técnica e profissional, poderá promover o aprofundamento em qualquer uma das áreas de conhecimento previstas na BNCC, possibilitando o desenvolvimento de conteúdos interdisciplinares.
IV. O núcleo obrigatório da BNCC garante a oferta da disciplina de química nos três anos do ensino médio sem redução de carga horária.
Em relação ao que é previsto na BNCC, estão corretas as afirmativas:
Identifique os tipos de reações a seguir:
I. CH3-CH2-(CH3)2C-Cl + OH- → CH3-CH2-(CH3)2→C-OH + Cl-
II. CH3-CH2-(CH3)2C-OH + H2SO4 → CH3-CH=C(CH3)2 + H2O + H2SO4
III. III. CH3-CH2-CH2-Cl + OH- → CH3-CH2-CH2- OH + Cl-
IV. CH3-CH2-CH=CH2 + HBr → CH3-CH2-CH(Br)- CH3
V. HOOC-(CH2)4-COOH + H2N-(CH2)6-NH2 → nH2O + [-NH-(CH2)6-NH-CO-(CH2)4-CO-]n
As reações expostas são, respectivamente:
Sobre as limitações de modelos explicativos, identifique os modelos atômicos nas afirmações abaixo:
I. Não explica as conclusões do experimento de Geiger–Marsden que consiste em um feixe de partículas alfa, normalmente executado em uma folha de ouro muito fina em uma câmara evacuada.
II. Não explica a natureza elétrica da Matéria.
III. Não explica o espectro de raia, formado por elementos multieletrônicos.
IV. Não está em acordo com a teoria do eletromagnetismo, que aponta que toda partícula com carga elétrica submetida a uma aceleração origina a emissão de uma onda eletromagnética.
As limitações apresentadas acima são, respectivamente, dos modelos atômicos:
I. Uma amostra de um sólido orgânico de alta pureza a ser analisado para identificar as possíveis funções orgânicas presentes em sua molécula.
II. Uma amostra de um composto orgânico analisada para contribuir na elucidação da estrutura da molécula a partir dos seus fragmentos que geram respostas de razão massa-carga.
III. Determinação da concentração de uma espécie conhecida, a partir da simples relação linear entre absorção da radiação eletromagnética e concentração.
IV. Injeção de uma amostra em uma chama, provocando a excitação eletrônica dos átomos, gerando um sinal analítico através da radiação UV-Vis gerada.
As situações descritas acima estão relacionadas, respectivamente, com as técnicas de:
Um estudante misturou 200mL de solução de ácido HX de concentração 0,1mol/L com 300mL de solução do sal de sódio desse ácido (NaX) que tinha concentração de 0,2mol/L. Sabendo que a constante de ionização do ácido HX é 0,000003. Qual o valor do pH da solução formada?