Questões de Concurso
Para químico
Foram encontradas 3.615 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Foi inventada por Alessandro Volta, que publicou seus experimentos em 1799 e é considerado o criador das pilhas elétricas, que desencadeou os diversos avanços no ramo da eletroquímica.
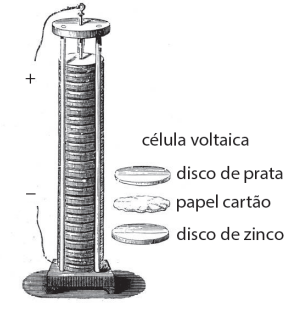
O dispositivo é feito de diversas camadas dos metais zinco e prata, separadas por um disco de material poroso embebido numa solução de sal, conforme representado pela figura ilustrada:
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) a respeito dessa descoberta.
( ) Os discos de zinco constituem o ânodo (oxidação) e os discos de prata constituem o cátodo (redução).
( ) A passagem de elétrons, no circuito externo, é do cátodo para o ânodo.
( ) Os discos de zinco sofrem corrosão com o funcionamento da pilha, cuja semirreação é: Zn(s) ➔ Zn2+ + 2 e– .
( ) O aumento do diâmetro dos discos não influencia a tensão fornecida pela pilha.
( ) Os discos de zinco são fontes de elétrons para o circuito externo.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Qual a quantidade de água, em mL, que deverá ser adicionada para que a concentração do soluto seja reduzida para 0,04 mol/L?
Sobre esse fenômeno, analise as possíveis explicações abaixo sobre o caso:
1. O ponto de ebulição da água aumenta com a adição de sal, pois há um aumento da intensidade da força de coesão entre os íons do sal e as moléculas da água.
2. A adição do sal resulta em uma diminuição da temperatura de ebulição da água.
3. A pressão de vapor da água aumenta devido à atração das moléculas da água com os íons do sal, o que dificulta a evaporação.
4. O abaixamento da pressão de vapor, em soluções diluídas, é diretamente proporcional à concentração do soluto.
Assinale a alternativa que indica todas as afirmativas corretas.
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nessas informações.
( ) A adição de mais água na solução saturada favorecerá a solubilização do sal, o que acarretará a diminuição da massa do precipitado.
( ) Se uma quantidade de solução saturada for retirada, ocorrerá um aumento da massa do precipitado.
( ) O aumento da temperatura favorecerá a solubilização do sal, o que caracteriza um processo endotérmico.
( ) Se a solução permanecer aberta e exposta ao ar, ocorrerá diminuição da massa de sal precipitado.
( ) A dissolução do sal em um líquido é sempre um processo exotérmico.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Na sequência, efetuou-se a filtração e o sólido não dissolvido foi separado e, depois de seco, medida a massa resultante.
A solubilidade do Ag2SO4 em água é 2,0×10–2 mol/L e sua massa molar é aproximadamente 312 g/mol.
Assinale a alternativa que indica corretamente a quantidade, em gramas, de sulfato de prata obtida após a filtração.
No gráfico abaixo estão representados os caminhos de uma reação com catalisador e uma sem catalisador.
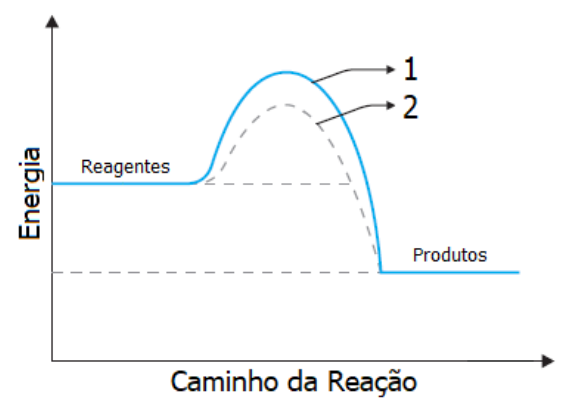
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nesse gráfico.
( ) A curva 1 refere-se à reação não catalisada e a curva 2 refere-se à reação catalisada.
( ) A energia de ativação da curva 1 é maior do que a da curva 2.
( ) A utilização de um catalisador na reação aumenta o valor de ∆H.
( ) O complexo ativado da curva 1 apresenta a mesma energia do complexo ativado da curva 2.
( ) Se a reação seguir o caminho da curva 2, ela será mais rápida.
Assinale a alternativa que indica a sequência correta,
de cima para baixo.
CuS + HNO3 ➔ Cu(NO3)2 + S + NO + H2O
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) em relação à reação dada.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
( ) A soma total de íons entre os produtos deve ser igual à soma total de íons entre os reagentes.
( ) O agente oxidante é o HNO3 e o agente redutor é o CuS.
( ) O total de elétrons cedidos pelo agente redutor deve ser igual ao total de elétrons recebidos pelo agente oxidante.
( ) Os coeficientes 3, 8, 3, 3, 2, 4 tornarão a equação balanceada.
Observe a equação abaixo: 3 MnO2 + KClO3 + 6 KOH ➔ 3 K2MnO4 + KCl + 3 H2O
Analise as afirmativas abaixo em relação ao assunto.
Analise as afirmativas abaixo em relação ao assunto.
1. O “Mn” do dióxido de manganês perdeu elétrons.
2. A soma dos índices mínimos inteiros é igual a 16.
3. MnO2 é o agente redutor e KClO3 é o agente oxidante.
4. O “K” do clorato de potássio não perdeu e nem ganhou elétrons.
Assinale a alternativa que indica todas as afirmativas corretas.
Nesse caso, assinale a alternativa que indica corretamente o que deve ser realizado.
Considere que você tem a tarefa de extrair teofilina a partir de uma solução aquosa contendo 3% de teofilina e utilizando um dos solventes cujas estruturas moleculares são mostradas a seguir.
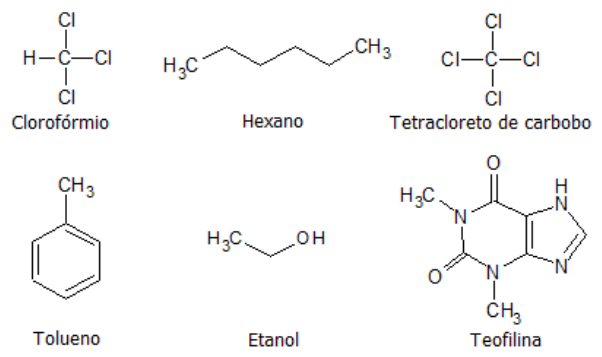
Assinale a alternativa que indica corretamente o solvente mais indicado para esse processo.
Assinale a alternativa correta em relação ao assunto.
A reação de eletrólise é classificada como:
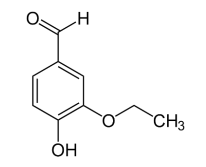
Com base nisso, assinale a alternativa que apresenta as funções químicas encontradas na etilvanilina.
É um lipídio constituído por um álcool policíclico de cadeia longa encontrado nas membranas celulares e no plasma sanguíneo de todos os mamíferos.
Observe a estrutura química apresentada abaixo.
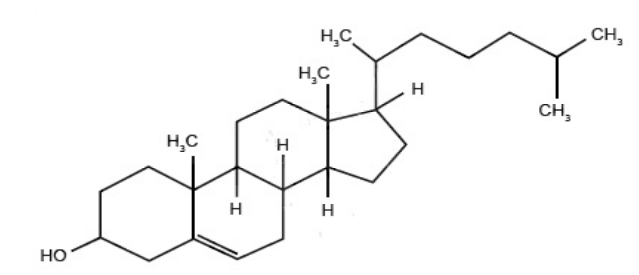
Assinale a alternativa correspondente à fórmula molecular do colesterol.
Em relação a essa classificação da água, é correto afirmar que:
No Brasil, o processo mais comum utiliza sulfato de alumínio (Al2(SO4)3) que é adicionado à água com o óxido de cálcio (CaO), mais conhecido como cal virgem.
Com os íons hidroxila presentes na água ocorre uma transformação química formando o hidróxido de alumínio, Al(OH)3. O resultado é que as partículas de impurezas aglutinam e “grudam” no hidróxido de alumínio, formando flocos sólidos. Com a ação da gravidade, ocorre a deposição dos sólidos. A água é então encaminhada para outra etapa de tratamento.
Assinale a alternativa correta em relação ao assunto.
Coluna 1 Substâncias inorgânicas
1. HCl
2. NaOH
3. NaClO
4. Na2CO3
5. NaHCO3
Coluna 2 Aplicação
( ) Usado como desinfetante.
( ) Usado em fermento para bolos, antiácido estomacal e em alguns extintores de incêndio.
( ) Usado na limpeza de pedras de mármore.
( ) Utilizado para produção de sabão.
( ) Usado no tratamento da água de piscina.
Assinale a alternativa que indica a sequência correta, de cima para baixo.