Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O ácido 2‐aminopropanoico pode ser representado conforme suas estruturas espaciais a seguir:
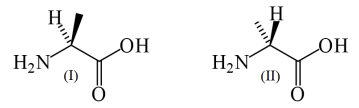
Baseado no sistema de nomenclatura de Cahn‐Ingold‐Prelog assinale a opção que melhor caracteriza o nome das
representações anteriores.
As estruturas químicas dos polímeros “Delrin” (plástico comercial) e o “Dracon” seguem representadas a seguir.
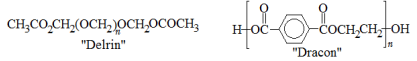
A opção que traz, na ordem, os monômeros formadores e suas classificações, quanto ao tipo de polimerização, é
O teste de chamas, utilizado para a detecção qualitativa de alguns cátions metálicos, é possível porque o comprimento de onda da luz visível emitida por cada átomo/íon é percebido como cor. Observe a tabela com os comprimentos de onda no vácuo referentes ao espectro da luz visível.
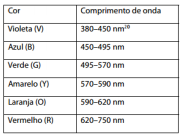
Em um ensaio de chama, para evitar confusões visuais das cores, a detecção foi realizada com auxílio de um
Colorímetro, que apresentou, para as amostras aquosas A, B e C, os comprimentos de onda 425 nm, 540 nm e 580 nm,
respectivamente. É correto afirmar que as amostras, nesta ordem, contêm cátions dos metais:
Determine o pH aproximado de uma solução tampão preparada pela adição de 14,5 g de bicarbonato de sódio e 9 g de carbonato de sódio em água suficiente para completar 500 mL de solução.
(Dados: pKa do ácido é 10,32 ; log 2 = 0,3 ; log1/2 = ‒0,3.)
Para o ciclo da glicose interagir com o ciclo de Krebs, há uma reação intermediária na qual a partir de cada molécula de Piruvato produz‐se uma de Acetil‐CoA. Essa etapa é fundamental, principalmente no fígado, que regula a glicemia no sangue, pois é irreversível. O Acetil‐CoA, quando utilizado para produzir energia será oxidado no ciclo de Krebs, formando CO2, água e ATP (trifosfato de adenosina ou adenosina trifosfato). O ATP é um nucleotídeo responsável pelo armazenamento de energia em suas ligações químicas. É constituído por adenosina (um nucleosídeo) associado a três radicais fosfato conectados em cadeia.
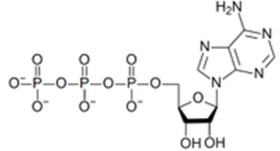
Onde, na molécula de ATP, está amarzenada esssa enegia para consumo no organismo humano?
Foi realizada uma titulação de 50 mL de uma solução de um diácido fraco de concentração 0,1 mol/L. Como titulante foi utilizada solução de NaOH a 0,1 mol/L. O volume gasto para atingir o ponto de equivalência nessa titulação foi de 50 mL. Escolha, dentre as opções, o indicador (dada a faixa de viragem) menos apropriado para a titulação, considerando um erro de 1%.
(Dados para o diácido: pKa1 = 3 e pKa2 = 8.)
Observe as seguintes reações orgânicas:
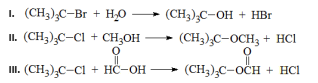
Quanto ao tipo de mecanismo e variáveis reacionais, é possível concluir, na ordem dada (I, II e III), que as reações são
Brometo de nitrosila é um gás vermelho que pode ser obtido pela reação do óxido nítrico com bromo molecular, de acordo com a seguinte equação química:
NO(g) + ½ Br2(g) → NOBr(g)
Resultados cinéticos da síntese desse gás estão representados na tabela a seguir:
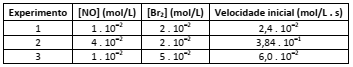
O valor da constante de velocidade da reação de obtenção do brometo de nitrosila, em L2
/mol2 . s, é igual a
Quando se estudam as diferentes classes de compostos inorgânicos mais comuns, percebe‐se que podem ser obtidas em um laboratório de química sem necessidade de aparatos complexos. Como exemplos, abaixo seguem propostas de algumas reações de obtenção de óxidos, ácidos, bases e sais:
I. Pb(NO3)2(s) 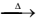 PbO(s) + 2 NO(g) + 1,5 O2(g)
PbO(s) + 2 NO(g) + 1,5 O2(g)
II. CaO(s) + SiO2(S) 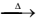 CaSiO3(L)
CaSiO3(L)
III. Cu(s) + H2SO4(conc) → CuSO4(aq) + H2(g)
IV. (NH4)2Cr2O7(s) 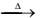 N2(g) + Cr2O3(s) + 4 H2O(L)
N2(g) + Cr2O3(s) + 4 H2O(L)
V. 2 NO2(g) + H2O(L) → HNO3(aq) + HNO2(aq)
VI. Pb(NO3)2(aq) + Fe(s) → não reativa
Das possibilidades de reações químicas apresentadas anteriormente, estão quimicamente corretas, de acordo com os
processos de síntese e reatividade dos compostos inorgânicos, apenas
A conversão de dióxido de enxofre em trióxido de enxofre é uma das etapas de formação da chuva ácida. Dados termodinâmicos, a 25°C são apresentados na tabela.
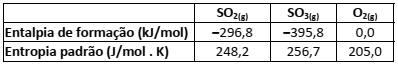
Em relação às características termoquímicas dessa reação, a 25°C, é possível afirmar que