Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Uma técnica usada em laboratórios químicos é a determinação das fórmulas empíricas (mínimas) pela análise por combustão. Nesse processo, queima-se uma amostra em um tubo por onde passa um fluxo abundante de oxigênio, sendo todo o hidrogênio do composto convertido em água e todo o carbono convertido em dióxido de carbono.
O equipamento utilizado é representado pela figura a seguir.
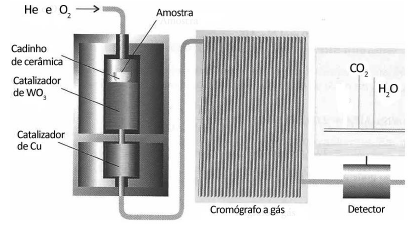
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água.
A fórmula empírica desse composto é:
Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.
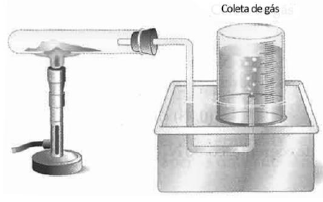
A reação observada pode ser representada pela equação:
2 KClO3 → 2 KCl+ 3 O2
Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente,
Dados: Massa Molar: KClO3 = 122,5 g.mol-1
Constante real dos gases R= 0,082atm.L.mol-1 .K-1
 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
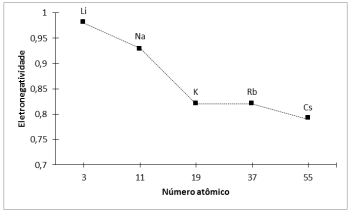
De acordo com os dados apresentados, o metal alcalino que estabelecerá com o flúor a ligação química de maior caráter iônico será o
A reação de síntese da amônia em fase gasosa
3H2
(g) + N2
(g)  2NH3
(g)
2NH3
(g)
é acompanhada por variações de entalpia e de entropia do sistema.
As variações de entalpia (kJ) e entropia (J.K–1 ) em função da temperatura são apresentadas nas figuras a seguir.
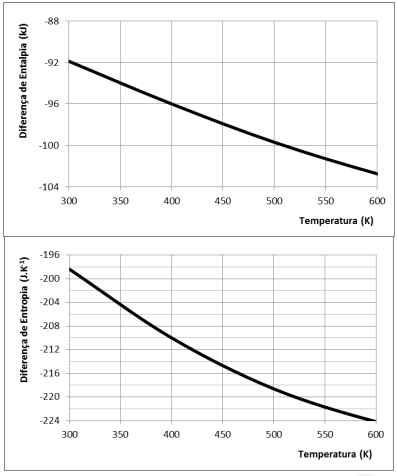
Utilizando os dados apresentados, o valor da energia livre de
Gibbs, em kJ, a 400 K é de
 2NO2
(g)
2NO2
(g)  H1
2N2O(g) + 3O2
(g)
H1
2N2O(g) + 3O2
(g) 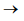 4NO2
(g)
4NO2
(g) 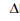 H2
H2 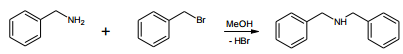 Em um experimento conduzido a 298 K, com excesso de
benzilamina, o perfil de decaimento do brometo de benzila foi
registrado, sendo apresentado na figura a seguir.
Em um experimento conduzido a 298 K, com excesso de
benzilamina, o perfil de decaimento do brometo de benzila foi
registrado, sendo apresentado na figura a seguir.
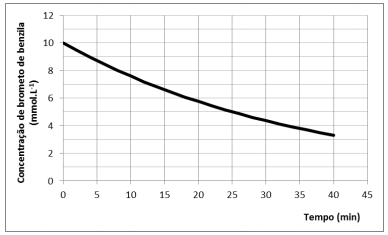
Nessas condições, o tempo (em minutos) em que a concentração de brometo de benzila terá sido reduzida à 1/8 da concentração inicial é de
A fórmula a seguir representa o ácido
7-[(1R,3R)-3-hidróxi-2-[(1E,3S)-3-hidróxi-oct-1-en-1-il] -5-oxo-ciclopentil]heptanoico,
foi uma das primeiras substâncias utilizadas para a impotência masculina. Os fármacos que possuíam esta droga na formulação deveriam ser injetados, o que tornava sua utilização inconveniente.
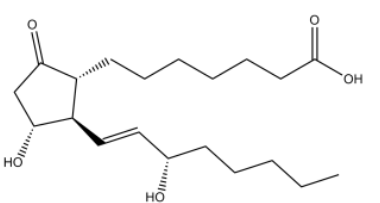
Analisando a nomenclatura e a fórmula desse ácido, é correto
afirmar que seus isômeros
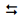 H2
(g) + I2
(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
H2
(g) + I2
(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc. 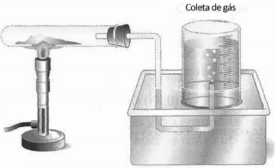
A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
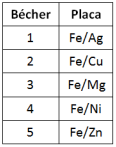
Considere a tabela a seguir.
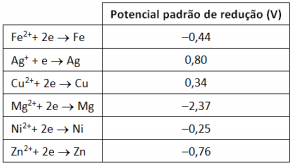
Após o mesmo tempo de observação, o bécher em que se verifica a menor taxa de corrosão da placa de ferro é o