Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Os mesmos produtos produzidos na eletrólise do NaCl puro são obtidos na eletrólise de uma solução aquosa de NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Na produção do sódio metálico, é possível realizar a eletrólise do NaCl na forma sólida.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A partir da localização do N a e do K na tabela periódica, é correto concluir que a eletrólise do KC1 requer a aplicação de um potencial elétrico maior que aquele requerido para a eletrólise do NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
No processo, sabendo que M(Na) = 23 g/mol, a circulação de uma corrente elétrica igual a 2,0 A em um intervalo de 4.825 s deve produzir uma massa superior a 2,0 g de sódio metálico.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximos item.
O potencial elétrico mínimo (E) que deve ser aplicado à célula eletrolítica para que ocorra a eletrólise do NaCl pode ser calculado pela equação E = E (Na+/Na) + 2E (Cl2/ Cl- ) , em que E ( Na+ /Na ) e E(C12 /Cl- ) são, respectivamente, os potenciais elétricos de redução dos pares Na+/Na e Cl2/Cl- na temperatura do experimento.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
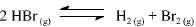
Com base nessas informações, julgue o item que se segue.
Se 0 HBr(g) for colocado em um recipiente fechado, sob
pressão inicial de 0,10 bar, e a temperatura do sistema for
elevada a 500 °C, a pressão parcial de H2(g), quando atingido o
equilíbrio, deve ser maior que 1,0 x 10-7 bar.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
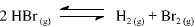
Com base nessas informações, julgue o item que se segue.
A 500 K, a constante de equilíbrio para a reação 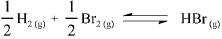 é maior que 1,0 x 104
é maior que 1,0 x 104
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
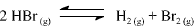
Com base nessas informações, julgue o item que se segue.
Um aumento de temperatura provoca um aumento da
velocidade da reação apresentada.
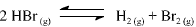
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
O íon acílio formado apresenta maior estabilidade que o carbocátion alquílico +CH2CH3.
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
O mecanismo apresentado envolve a quebra homolítica de uma
ligação química covalente.
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
O A1C13 apresenta três ligações covalentes polares e a
molécula, como um todo, é apoiar.
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
No mecanismo apresentado, o A1C13 atua como um ácido de
Lewis.
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
O anidrido acético envolvido na reação pode ser obtido por
meio da reação do etanol com o ácido acético, catalisada por
um ácido forte.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue o item seguinte.
O ibuprofeno pode existir na forma de dois enantiômeros
distintos ou na forma de uma mistura racêmica.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue os itens de 89 a 103.
Todos os com postos representados nas rotas sintéticas
descritas são polares.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Com exceção do com posto X, todos os demais com postos representados nas rotas sintéticas descritas são capazes de formar ligações de hidrogênio com a água.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e compostos envolvidos, julgue o item seguinte.
A análise das estruturas moleculares permite inferir que a
acidez do ibuprofeno é maior que a do composto B2, que é
maior que a do composto B l, que é maior que a do
composto X.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue o item seguinte.
A etapa que consiste na transformação do com posto B2 no
ibuprofeno pode ser realizada, alternativamente, pela reação
desse composto com ácido crômico.