Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. A análise __________ é um método físico-químico empregado para separar componentes de uma mistura.
II. A análise ___________ tem por base a reação de um analito com um reagente apropriado, adicionado na forma de uma solução padrão, cujo volume necessário para completar a reação é medido.
III. A análise __________ de precipitação requer a conversão da substância que está sendo determinada num precipitado insolúvel que é recolhido e pesado.
IV. A análise ___________ tem por base a deposição eletrolítica do elemento a ser determinado, sobre um eletrodo conveniente.
Assinale a alternativa que corresponde ao preenchimento correto das lacunas, de cima para baixo:
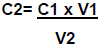
onde:
C2 = Concentração da solução em estudo.
C1 = Concentração da solução padrão.
V1 = volume gasto na bureta.
V2 = Volume da alíquota.
Considerando que cada uma das variáveis tenha incerteza padrão já identificada e quantificada ( uC1,uV1,uV2), e sabendo que no cálculo da incerteza final de um procedimento todas as contribuições de incertezas, expressas como padrão, podem ser combinadas, assinale a alternativa que apresenta a expressão que deve ser utilizada para o cálculo da incerteza combinada (uc).
I. Amostragem casual é o melhor método de amostragem a ser adotado, pois permite que todo o material seja analisado.
II. Uma amostra representativa permite estimar uma ou mais características para a totalidade de uma população.
III. Em líquidos, a homogeneidade do material a ser amostrado pode ser garantida pelo processo de agitação.
IV. Amostras sólidas sempre são homogêneas e não requerem procedimentos prévios à coleta.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
A figura abaixo representa dados obtidos experimentalmente para a verificação de condições de reprodutibilidade e repetitividade de um método analítico. Foram realizadas determinações de um material de referência por três analistas diferentes, que fizeram cinco replicatas cada um, que geraram três valores médios, os quais estão representados por pontos e linhas na figura abaixo.
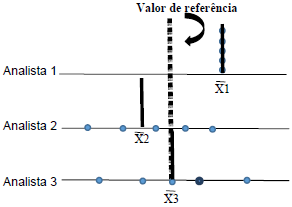
Considerando a situação exposta, assinale a
alternativa que apresenta as duas afirmações
CORRETAS:
Este relato é um histórico importante sobre o elemento ferro, que pode ser obtido através da hematita (óxido férrico). Para a formação da hematita ocorre uma reação entre ferro metálico e gás oxigênio. Considerando este processo químico, quantas gramas de hematita, podem ser obtidas quando 20 mols de ferro reagem com quantidade suficiente de oxigênio? Assinale a alternativa CORRETA.
Uma das preocupações quando se vai proceder uma análise química é a escolha e limpeza adequada da vidraria utilizada. Dentre as mais usadas para se fazer transferências de volumes estão as pipetas. Sendo que a pipeta _______________ é calibrada para transferir um volume _______________. Sendo que a última gota do líquido não deve ser soprada. Já a pipeta _______________ é calibrada como uma bureta, sendo empregada para volume _______________. Quando a análise requer uma maior exatidão, deve ser utilizada a pipeta _______________.
Qual é a alternativa que completa, CORRETA e respectivamente, as lacunas do texto acima?
Em um laboratório de química analítica, um estudante encontrou um frasco com uma solução contendo, o seguinte rótulo: “cátion do grupo IV”. Para rotular corretamente, o aluno realizou alguns testes com alguns reagentes comuns para identificação de cátions do grupo IV e fez as seguintes observações:
1º) Ao fazer o teste utilizando solução de amônia, nenhum precipitado foi observado;
2º) Empregando uma solução de carbonato de amônio, um precipitado de cor branca foi formado, sendo este solúvel em ácidos minerais diluídos;
3º) Após utilizar ácido sulfúrico diluído, ocorreu a precipitação de um sólido branco, pesado e finamente dividido, que foi praticamente insolúvel em água.
Com base nos testes e observações do
estudante, o cátion presente no frasco mal
rotulado é?
Considerando as estruturas dos compostos abaixo, assinale a alternativa CORRETA em relação às ligações químicas estabelecidas entre seus átomos constituintes.
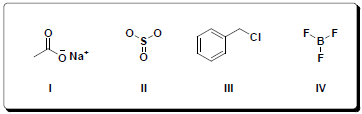
Com relação ao equilíbrio químico e aos fatores que o deslocam, assinale a alternativa CORRETA.
O ácido sulfúrico é muito importante na indústria, pois é utilizado no refino de petróleo, na fabricação de explosivos, na indústria de fertilizantes, bem como emprego para obtenção de outros ácidos. Este é considerado um _______________, pois apresenta _______________, possuindo fórmula molecular_______________.
Assinale a alternativa que completa, CORRETA e respectivamente, as lacunas do texto acima:
( ) Dalton afirmava que os átomos são permanentes e indivisíveis e que as transformações químicas consistem em uma separação, combinação ou rearranjo de átomos. Sua teoria contribuiu para explicação da conservação das massas em uma reação química.
( ) Após lançar o modelo de “pudim de ameixas" o físico inglês J. J. Thomson, anos mais tarde, postulou que os elétrons, carregados negativamente, estavam arranjados em anéis e circundavam completamente em órbitas a esfera positiva.
( ) Rutherford apresentou um modelo de átomo que possuía um pequeno núcleo rodeado por um grande volume no qual os elétrons estão distribuídos. O núcleo carrega toda a carga positiva e também toda massa do átomo.
( ) Bohr desenvolveu um modelo atômico no qual postulou a existência de níveis de energia eletrônica quantizada. O mesmo atentou para o fato de que os elementos exibem um espectro de linhas.
Assinale a seguir a alternativa CORRETA, na sequência de cima para baixo:
As pilhas e baterias são amplamente utilizadas em nossa sociedade como fonte de energia para diversos aparelhos eletroeletrônicos. Do ponto de vista químico, a energia elétrica fornecida por uma pilha é oriunda de uma reação de oxirredução espontânea. Uma pilha de mercúrio, que é utilizada em marca-passos, envolve as seguintes semi-reações e os respectivos potenciais padrão (Eº) a 25 ºC:
ZnO + H2O + 2e-
 Zn + 2OH- (Eº = -
1,26 V)
Zn + 2OH- (Eº = -
1,26 V) HgO + H2O + 2e-
 Hg + 2OH- (Eº =
0,098 V)
Hg + 2OH- (Eº =
0,098 V)Com relação à pilha, a alternativa INCORRETA é:
Quando um sal se dissolve em água, a solução pode ser ácida, básica ou neutra, dependendo da natureza do sal. Sabendo disso, é correto afirmar que a hidrólise do acetato de amônio (NH4C2H3O2) em água resulta em uma solução:
(Dado: Ka do ácido acético = 1,8 x 10-5 e Kb da
amônia = 1,8 x 10-5).