Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

Com base nessas informações, julgue o próximo item.
Nessa reação, a dipirona atua como uma base de
Brønsted-Lowry.

Com base nessas informações, julgue o próximo item.
A degradação da dipirona ocorre por hidrólise.

Com base nessas informações, julgue o próximo item.
O NaOH é um óxido básico binário.

Com base nessas informações, julgue o próximo item.
A função da fenolftaleína nessa titulação é tamponar a
solução.

Com base nessas informações, julgue o próximo item.
Considerando-se que 500 mg de comprimido de HAS
tenham sido dissolvidos em água e que a titulação desse
ácido com NaOH 0,100 mol/L tenha gasto 25,00 mL,
é correto concluir que a porcentagem de HAS no
comprimido é superior a 91%.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua
camada de valência.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação
semimetais.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
A eletronegatividade é a quantidade de energia envolvida no
processo em que o átomo isolado em seu estado fundamental
recebe um elétron.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O carbono assume número de oxidação negativo quando
ligado a metais fortemente eletropositivos, como no caso do
CaC2.
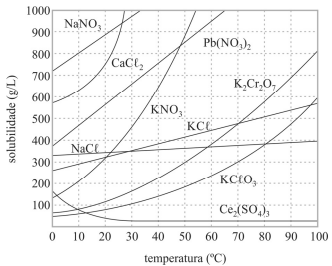
Em solução supersaturada, a concentração de soluto é superior à sua solubilidade a uma dada temperatura; mesmo assim, esse soluto permanece dissolvido após aquecimento e lento resfriamento do sistema.

A 50 °C, uma solução de 100 mL que contém 80 g de KNO3 é classificada como insaturada.

Uma solução de cloreto de potássio a 10 °C possui concentração em quantidade de matéria superior a 4,2 mol/L.

Todos os compostos referenciados no gráfico apresentado são iônicos e apresentam elevadas temperaturas de fusão e ebulição.

Considere-se que uma solução de nitrato de sódio (NaNO3) tenha sido preparada a 20 °C, dissolvendo-se 1,00 mol de NaNO3 em 100 mL de água, e que, posteriormente, esse sistema tenha sido resfriado a 10 °C. Nesse caso, a massa do precipitado formado é superior a 40 g.

As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
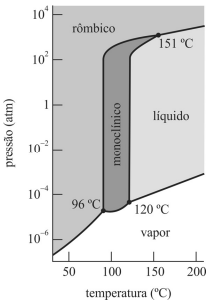
Quando submetido à pressão de 1 atm e à temperatura de 170 °C, o enxofre está na fase sólida.

O diagrama de fases do enxofre possui três pontos triplos, mas não é possível observar a existência simultânea de quatro fases.

As três fases do enxofre podem coexistir nas temperaturas de 96 °C, 120 °C e 151 °C.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.