Questões de Concurso
Para técnico de química
Foram encontradas 101 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Uma mistura ácida é feita com 100,00 mL de solução aquosa 1,00 mol L-1 de HCℓ e 250,00 mL de solução aquosa 2,00 mol L-1 de HNO3 , ajustado, com água, o volume final para 1,0 L. Uma alíquota de 100,00 mL dessa mistura de ácidos foi coletada e neutralizada com solução 0,50 mol L-1 de NaOH.
O volume, em mL, da solução de base forte que foi necessário para promover a neutralização foi
O nióbio é um elemento usado para produção de aços com propriedades especiais. Na natureza, ele ocorre na forma de pentóxido de nióbio, de onde se pode obter o nióbio metálico por um processo térmico, usando uma mistura de alumínio e óxido de ferro (III), como mostrado na equação química a seguir.
3 Nb2O5(s) + Fe2O3(s) + 12 Al(s) → 6 Nb(s) + 2 Fe(s) + 6 Al2O3(s)
O processo térmico em questão produz o nióbio metálico com rendimento de 80%.
O valor aproximado da massa de Nb, em tonelada, que seria obtida a partir de 1,6 toneladas de Nb2O5 é
Dados
M (Nb) = 93 g mol-1
M (Nb2O5
) = 266 g mol-1
O rótulo de um frasco de solução de ácido nítrico concentrado (com 65% de HNO3 m/m) indica que 1,0 L tem massa igual a 1,4 kg. Deseja-se preparar 250 mL de uma solução 3,0 mol L-1 de HNO3 , com apenas uma etapa de diluição do ácido concentrado com água pura.
Para tal preparação, o volume aproximado de ácido necessário, em mL, é
Dados
M (HNO3
) = 63 g mol-1
A reação representada na equação abaixo é lenta e reversível, mas seu rendimento é melhorado com a adição de quantidades catalíticas de ácido sulfúrico.
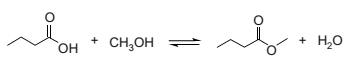
Nessa reação,
O captopril, cuja estrutura está representada a seguir, é um medicamento usado para o controle da pressão arterial.
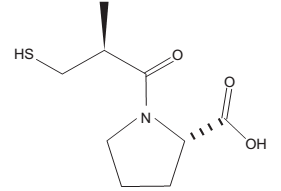
Sobre o captopril, verifica-se que ele