Questões de Concurso
Para químico de petróleo júnior
Foram encontradas 306 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
1. de um estado inicial a 100 o C e 1 bar, é comprimido adiabaticamente até 150 o C;
2. em seguida, é resfriado de 150 o C a 100 o C, a pressão constante;
3. finalmente, é expandido isotermicamente até o seu estado original.
Para o ciclo completo, as variações de energia interna (?U) e entalpia (?H) são
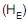 e a energia interna específica do gás no interior do tanque, após o enchimento (U), é
e a energia interna específica do gás no interior do tanque, após o enchimento (U), é
Disponível em: http://teses.icict.? ocruz.br/pdf/paulajfpm.pdf
Acesso em: 08 out. 2010. (Adaptado)
Em relação a algumas reações que podem ser realizadas com o estragol, transanetol e cisanetol, analise as afirmativas a seguir.
I - Os produtos principais da reação de hidrogenação de (P) e (Q), catalisada por platina a 25 °C e a pressão de 1 atm, são isômeros constitucionais.
II - Tanto (Q) como (R) podem descorar uma solução de
 em tetracloreto de carbono com a formação de um mesmo produto principal de reação.
em tetracloreto de carbono com a formação de um mesmo produto principal de reação. III - A reação de (P) com HBr pode levar a formação de um produto de reação idêntico ao obtido na reação de (Q) com HBr.
IV - O calor liberado na reação de hidrogenação da dupla olefínica de (Q) é menor do que na de (R).
Estão corretas APENAS as afirmações
A partir dos resultados obtidos nesse experimento, conclui-se que
PORQUE
O eletrodo Ag/AgCl tem um potencial conhecido, que é essencialmente constante e insensível à composição das soluções de estudo, sendo, ainda, construído com base em uma reação reversível; obedece à Equação de Nerst, pode retornar ao seu potencial original após ser submetido a pequenas correntes e exibe baixa histerese sob ciclos de temperatura.
A esse respeito, conclui-se que
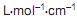 Foi analisada por espectroscopia na região do UV/Vis em um comprimento de onda na qual se obedece à lei Lambert Beer na concentração empregada nesse experimento. Considere que o caminho óptico é de 1 mm, e a absorbância observada é 0,4. Empregando esse resultado na equação de Lambert-Beer, conclui-se que a concentração da amostra é, aproximadamente,
Foi analisada por espectroscopia na região do UV/Vis em um comprimento de onda na qual se obedece à lei Lambert Beer na concentração empregada nesse experimento. Considere que o caminho óptico é de 1 mm, e a absorbância observada é 0,4. Empregando esse resultado na equação de Lambert-Beer, conclui-se que a concentração da amostra é, aproximadamente,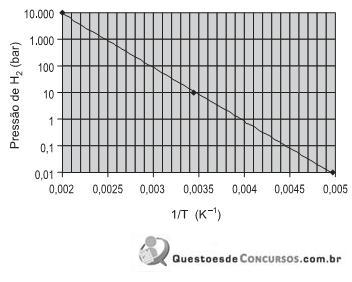
O armazenamento de hidrogênio em volumes reduzidos pode ser conseguido por meio da formação de hidretos metálicos. O gráfico de Van’t Hoff apresentado acima exibe a pressão de equilíbrio de hidrogênio, em função da temperatura para a seguinte reação:
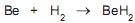
Qual a variação de entalpia, em kJ, estimada para essa reação?
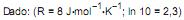
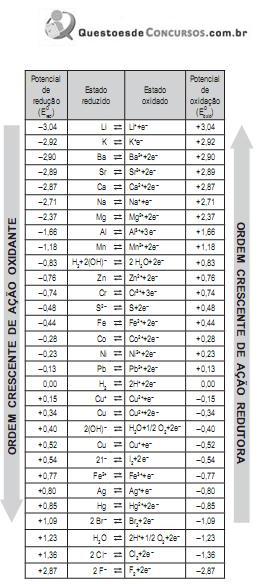
O cobre pode ser obtido por processamento hidrometalúgico de minérios ou concentrados. A rota usual consiste em lixiviação ácida, purificação por extração com solventes e obtenção final por eletrorredução do metal em soluções ácidas de sulfato de cobre. Com base na tabela acima, qual impureza prejudica significativamente a eficiência de corrente nessa última etapa do processo?
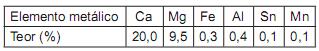
Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.
• Segundo a teoria de Arrhenius, “um ácido é todo composto molecular que, em solução aquosa, se ioniza, produzido exclusivamente como cátion o
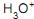 (hidroxônio) e que pode ser representado por
(hidroxônio) e que pode ser representado por 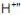 , e “uma base é um composto que em solução aquosa sofre dissociação iônica, produzindo íon hidroxila”.
, e “uma base é um composto que em solução aquosa sofre dissociação iônica, produzindo íon hidroxila”. • Segundo a teoria de Brønsted-Lowry, “os ácidos são moléculas ou íons doadores de prótons” e “as bases são moléculas ou íons aceitadores de prótons”.
• Segundo a teoria de Lewis, “um ácido é um aceitador de par de elétrons”, e “uma base é um doador de par de elétrons”.
Com base nessas teorias, analise as afirmações abaixo.
I -
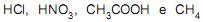 são considerados ácidos, e
são considerados ácidos, e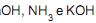 são considerados bases, segundo a teoria de Arrhenius.
são considerados bases, segundo a teoria de Arrhenius. II -
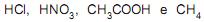 são considerados ácidos, e
são considerados ácidos, e 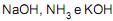 são considerados bases, segundo a teoria de Brønsted-Lowry.
são considerados bases, segundo a teoria de Brønsted-Lowry.III - Na reação
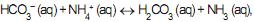 , o íon amônio
, o íon amônio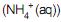 e o ácido carbônico
e o ácido carbônico 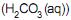 são considerados ácidos de Brønsted-Lowry, e as espécies
são considerados ácidos de Brønsted-Lowry, e as espécies  são bases de Lewis.
são bases de Lewis.Está correto APENAS o que se afirma em
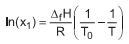
Sabe-se que:
• X1 é a fração molar de solvente em solução que cristaliza na temperatura T;
• ΔfH e T0 são, respectivamente, a variação de entalpia e a temperatura de fusão do solvente puro;
• R é a constante universal dos gases que pode ser aproximada por 2 cal/(mol•K);
• a variação de entropia de fusão do benzeno puro é 8 cal/(mol•K);
• a massa molar do benzeno é 78 g/mol;
• a temperatura de fusão do benzeno (T0) é 278,5 K.
A massa molar do soluto, a 278 K, necessária para a cristalização do benzeno a partir de uma solução de 10 g de soluto em 780 g de benzeno, em g/mol, é
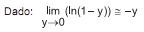
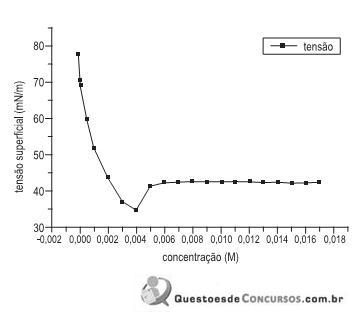
A figura acima apresenta dados experimentais de tensão superficial em função da concentração de surfactante (tenso-ativo) não iônico. Notam-se duas regiões distintas, uma de 0 a 0,003 M, e outra para concentrações acima de 0,005 M. A partir de uma análise, conclui-se que
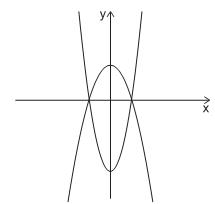
A área da região compreendida entre os dois gráficos é
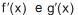 e são as derivadas das funções f(x) e g(x), respectivamente
e são as derivadas das funções f(x) e g(x), respectivamente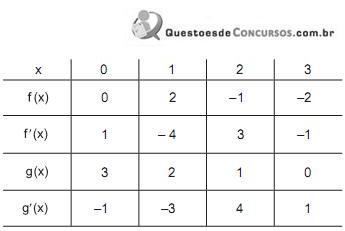
O valor de
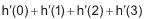 é
é