Questões de Concurso
Para químico de petróleo júnior
Foram encontradas 306 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Devido à tensão superficial do líquido de densidade ρ, o líquido sobe dentro dos tubos 1 e 2, como mostrado na Figura.
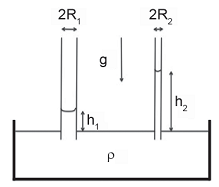
Se 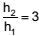 , o valor da razão R2 /R1 é
, o valor da razão R2 /R1 é
Podemos medir a tensão superficial de um fluido pelo método da gota caindo por um tubo fino de raio R, como ilustrado na Figura.
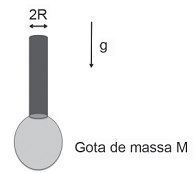
Se a massa da gota imediatamente antes de cair era M, a
tensão superficial do fluido 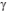 é dada por
é dada por
As funções reais de variáveis reais f e g estão representadas abaixo, no mesmo sistema de eixos cartesianos, sendo 0 e 4 os zeros da função quadrática f, e g uma função linear que intersecta o gráfico de f nos pontos (0,0) e (3, 6). Seja S a região do plano (sombreada) constituída de todos os pontos que estão abaixo do gráfico de f e acima do gráfico de g.
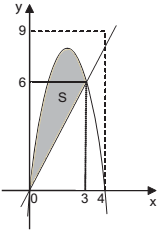
A área da região S corresponde a que fração da área do
retângulo de vértices (0, 0), (4, 0), (4, 9) e (0, 9)?
Dois processos de redução de corrosão em embalagens químicas estão sendo avaliados. O processo X opera com um percentual médio de redução de corrosão μ1 , desconhecido, e com variância 225, enquanto o processo Y opera com um percentual médio de redução de corrosão μ2 , também desconhecido, e com variância 576. Uma amostra de 25 embalagens, fabricadas de acordo com o primeiro processo, e outra de 36, de acordo com o segundo, foram selecionadas, fornecendo percentuais médios de redução de corrosão iguais a 47% e 52%, respectivamente. Considerando significativas as diferenças padronizadas com mais de 2 desvios da média, para mais ou para menos, observe as afirmações abaixo:
I - O processo Y mostra-se significativamente mais efetivo na redução da corrosão das embalagens.
II - Um intervalo de confiança significativo para as diferenças entre as reduções médias dos dois processos poderia ser (3% , 7%).
III - O teste estatístico, de diferença das médias, levaria à conclusão de que os dois processos são equivalentes para a redução na corrosão das embalagens, nas condições descritas.
Está correto APENAS o que se afirma em
Um processo de enchimento de latas de óleo está dimensionado para encher latas de óleo carburante com o conteúdo de 500 mL em média e com variância de 100 mL2 . O setor de controle de qualidade investiga lotes de 25 latas e refuta aqueles que apresentam conteúdo médio além ou aquém de 1,96 unidade de desvio da média, conferindo uma confiabilidade de 95% à decisão de acertadamente aceitá-lo. Três lotes foram selecionados ao acaso em dias alternados e apresentaram conteúdo médio de 497 (1° dia), 508 (2° dia) e 495 (3° dia).
Diante desses resultados, o responsável pelo controle de qualidade da empresa deve
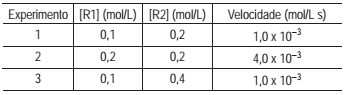
A equação química abaixo é da reação, que ocorre no estado gasoso, entre dois reagentes (R1 e R2 ) formando um produto único P.
R1(g) + R2(g) → P(g)
De um conjunto de experimentos foram coletados dados
que foram organizados na seguinte Tabela:
Uma gota das soluções de três substâncias diferentes foi depositada, lado a lado, na linha da amostragem de uma placa de cromatografia de camada delgada de fase estacionária de caráter polar. A borda inferior da placa foi mergulhada em solvente, de caráter apolar, de forma que ele, por capilaridade, percolasse a fase estacionária. Após algum tempo, a linha da frente do solvente foi marcada, e a placa foi retirada e deixada secar. As manchas escuras deixadas por cada uma das substâncias no registro cromatográfico são indicadas na ilustração seguinte.
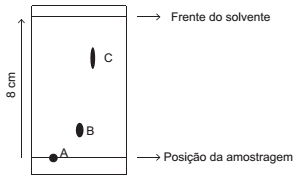
Com base no registro cromatográfico, tem-se que
A curva analítica obtida para Sr, usando espectrometria de emissão atômica, foi construída a partir dos dados brutos, descritos na Tabela a seguir, em termos de concentração de Sr
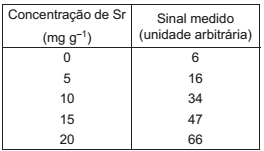
Após correção com branco, constatou-se que a curva analítica passava pela origem, ou seja, pelo ponto (0,0).
Se o sinal bruto obtido de uma solução de amostra foi de
39 unidades arbitrárias, a concentração aproximada de Sr
na solução de amostra, em mg g-1
, é
Na titulação fotométrica, com monitoramento da absorvância da solução em 330 nm, o analito A, em solução, reage com o reagente titulante T para formar o produto P de acordo com a equação a seguir:
A(aq) + T(aq) → P(aq)
A curva de titulação obtida é mostrada abaixo.
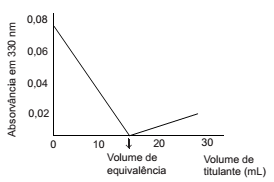
Com base nas informações acima, conclui-se que
A seguir é mostrada a equação da reação entre cloro e estireno.
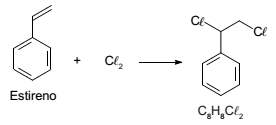
Sobre a reação, seus reagentes e o produto listam-se abaixo três afirmativas:
I - Os átomos de cloro no produto estão na configuração cis.
II - Em relação ao estireno, o produto clorado tem maior massa molar.
III - O estireno é um hidrocarboneto alifático.
Está correto APENAS o que se afirma em
Uma solução foi preparada com a mistura de 360 g de água pura com 160 g de um solvente orgânico. Em uma certa temperatura, a pressão de vapor da mistura foi 4,3 kPa. Com base no valor da pressão de vapor da mistura, e nas opções abaixo, pode-se concluir que o solvente orgânico usado foi
Dados:
• Pressão de vapor da água pura: 2,0 kPa
• Pressão de vapor do solvente orgânico: 13,5 kPa
• M (água) = 18,00 g mol-1
Uma amostra de minério (20,00 g) foi previamente solubilizada com uma mistura de ácidos inorgânicos e posteriormente diluída com água para ajustar seu volume para 1,00 L. Dessa solução, separam-se 250,00 mL que foram colocados em uma célula de um sistema eletrogravimétrico. Após a aplicação de um potencial adequado, o cobre da solução foi depositado, seletivamente, na superfície de um eletrodo de platina (em forma de rede para se ter elevada área superficial).
Se a massa de cobre depositada no eletrodo foi igual a 1,55 g, a percentagem (m/m) no minério é
A concentração de vitamina C (C6 H8 O6 ) foi determinada por coulometria usando eletrodo de platina. No processo, aplicou-se uma diferença de potencial para formar I- , a partir de um excesso de I2 presente na solução onde a amostra foi adicionada. A espécie I3- (formada a partir de I- e I2 ) reagiu com a vitamina C, oxidando-a (ver equações a seguir).
C6 H8 O6 + I3 - → C6 H6 O6 + 3I- + 2 H+
Em que I3 - + 2e → 3I-
Sabe-se que 25,00 mL de solução de amostra foram adicionadas à célula coulométrica, e que foram requeridos 12 min e
52 s da aplicação de 25 mA de corrente para oxidar quantitativamente a vitamina C.
Com base nessa informação, a concentração de vitamina C (em mol L-1 ) na solução de amostra é de
Dado
Carga de 1 mol de elétrons = 96500 C
C = A s
Uma solução aquosa foi preparada pela dissolução de 0,020 mol de hidroxilamina (HO-NH2 ) em 250,00 mL de água pura. A equação do equilíbrio de ionização do HO-NH2 em água e sua constante, a 25°C, estão apresentadas abaixo.
HO-NH2 (aq) + H2O(ℓ) = HO-NH3 + (aq) + OH- (aq) Kb = 5 x 10-9
A concentração, em mol L-1 , de OH- na solução é
Um volume de 500 mL de uma solução aquosa, contendo 0,0040 mol L-1 de Ba2+ foi misturada com 500 mL de uma solução 0,0060 mol L-1 de ácido sulfúrico, promovendo a reação conforme ilustrado na Equação I a seguir:
Ba2+ (aq) + H2SO4 (aq) → BaSO4 (s) + 2 H+ (aq) (Equação I)
O BaSO4 produzido se dissocia, estabelecendo um equilíbrio de solubilidade como indicado na Equação II a seguir:
BaSO4(aq) ⇋ Ba2+ (aq) + SO42- (aq) ; Kps = 1 x 10-9 (Equação II)
A solução resultante (de volume igual a 1000 mL) se encontra a 25°C. Conforme as condições indicadas, e ignorando a
influência da força iônica no equilíbrio de solubilidade, mas considerando o excesso de SO42- em solução, a concentração
aproximada de Ba2+ residual na solução, em mol L-1
, é
O enxofre do H2S dissolvido em água pode ser precipitado por um processo eletrolítico, como indicado na equação a seguir.
H2 S(aq) + I2(aq) → S(s) + 2H+ (aq) + 2I- (aq)
Um recipiente de 20 L contém uma mistura de nitrogênio e um gás não identificado, a 305 K. A massa de nitrogênio no recipiente é 168 g, enquanto a massa do outro gás é igual a 88 g.
Se a pressão total no recipiente é 10 atm, e o comportamento dos gases é ideal, o gás não identificado na mistura pode ser o
Dado
R = 0,082 atm L mol-1
K-1
A seguir têm-se quatro afirmações sobre o comportamento de um gás ou de uma mistura de gases encerrados em recipientes de volumes constantes. Observe-as:
I - Na mesma temperatura, quantidades iguais, em mol, de dois gases, que se comportam idealmente, exercem pressões parciais diferentes por terem massas molares diferentes.
II - Quando o fator de compressibilidade de um gás (Z) é igual a 0,5, pode-se considerar que ele se comporta idealmente.
III - O volume ocupado pelo gás, que se comporta idealmente, é diretamente proporcional à sua temperatura.
IV - Dois gases, que se comportam idealmente e não reagem entre si, têm a pressão total igual à soma das pressões exercidas por cada gás individualmente.
É correto APENAS o que se afirma em
Um resíduo aquoso, de volume igual a 30,0 L, contém dissolvidos 1,0 × 10-2 mol L-1 de Pb2+ e 2,0 × 10-2 mol L-1 de Hg22+. Esses íons foram precipitados com a adição de uma solução aquosa de ácido sulfúrico 1,0 mol L-1 , de acordo com as equações a seguir, em volume suficiente para garantir excesso de sulfato.
Pb2+ (aq) + SO4 2- (aq) → PbSO4 (s)
Hg2 2+ (aq) + SO4 2- (aq) → Hg2 SO4 (s)
A massa de precipitado, em gramas, que seria obtida, considerando a reação quantitativa, é mais próxima de
Dados
M (PbSO4 ) = 303 g mol-1
M (Hg2 SO4 ) = 497 g mol-1