Questões de Concurso
Para técnico de operação júnior
Foram encontradas 736 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
CO2(g) ⇌ CO2(aq)
CO2(aq) + H2O(ℓ) ⇌ H2CO3(aq)
H2CO3(aq) ⇌ HCO3-(aq) + H+(aq)
A composição da solução e o efeito de eventuais perturbações deste sistema são tais que a(o)
Nanopartículas esféricas de ouro são estruturas que contêm centenas de átomos de Au. A superfície dessas nanopartículas apresenta carga elétrica advinda de uma camada de íons provenientes do reagente usado na redução do Au3+ para o Au que forma a nanopartícula. A elevada relação superfície-volume e a carga superficial mantêm as nanopartículas dispersas homogeneamente no meio aquoso.
Considerando que cada uma das nanopartículas tenha 100 átomos de Au e que a concentração de Au3+ na reação que originou a dispersão era de 1 x 10-6 mol L-1, o número de nanopartículas de ouro em 5 mL de dispersão aquosa será de
Dado
1 mol de átomos = 6 x 1023 átomos
O gás dióxido de enxofre (SO2) reage com o gás NO2 formando o trióxido de enxofre, que promove a acidificação da água da chuva.
SO2(g) + NO2(g) ⇌ SO3(g) + NO(g)
A constante de equilíbrio (Kc) dessa reação é igual a 25 a 400 K. Nessas condições, coloca-se em um reator, de volume fixo, a quantidade de gases necessária para se ter, inicialmente, 1 mol L-1 de cada um dos quatro gases.
Ao se atingir o equilíbrio, a concentração de SO3(g) no sistema, em mol L-1, será mais próxima de
O clorato de potássio (KClO3), quando aquecido, se decompõe segundo a equação química abaixo.
2 KClO3(s) → 2 KCℓ(s ) + 3O2(g)
Uma mistura com massa desconhecida contém apenas KCℓO3 e KCℓ e foi aquecida produzindo 0,175 mol do gás oxigênio proveniente da reação de decomposição completa do KCℓO3. Após o aquecimento, a massa final de KCℓ foi de 25,0 g.
Dessa forma, a massa total aproximada, em gramas, da mistura que foi aquecida era de
Dados
M(KCℓ) = 75 g mol-1
M (KCℓO3) = 123 g mol-1
Em plantas industriais, a temperatura é uma variável importante, que pode ser usada para monitorar a pureza de um produto ou a conversão de uma reação, sendo bastante comum o uso do instrumento termopar para sua medição.
O termopar é um sensor de temperatura que consiste em
Em um experimento, um ímã percorre a trajetória reta AB, com velocidade constante, atravessando uma espira metálica conectada a um voltímetro, como mostra a Figura abaixo.
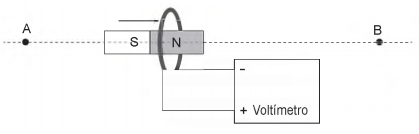
A voltagem indicada pelo voltímetro ao longo da trajetória do ímã é aproximadamente representada pelo seguinte gráfico:
O diagrama de linhas de campo elétrico gerado por esferas puntiformes carregadas eletricamente com cargas Q1 e Q2 é mostrado abaixo.

Com base nas informações fornecidas por este diagrama,
conclui-se que as cargas Q1 e Q2 são
Uma máquina utiliza um pequeno aquecedor composto por um resistor de potência e tensão nominais 15,0 W e 9,00 V. Para alimentar o aquecedor, é utilizada uma fonte de corrente contínua ideal de 30,0 V em série com um resistor R, como mostra a Figura abaixo.
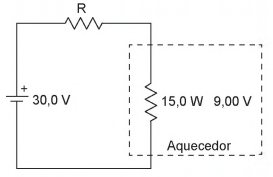
O valor aproximado da resistência elétrica de R, em Q,
para que o aquecedor trabalhe com potência e tensão nominais,
é
O circuito da Figura abaixo utiliza uma fonte de tensão alternada para alimentar três LEDs.
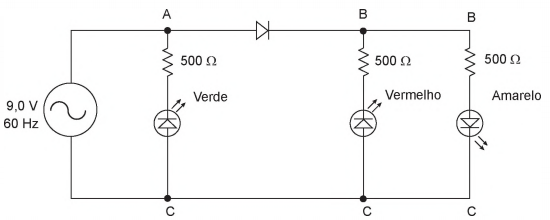
Entretanto, ao ligar o circuito, o técnico observou que nem todos os LEDs estavam emitindo luz.
Uma alteração no circuito que faria com que todos os LEDs emitissem luz seria
O elevador mostrado na Figura abaixo é utilizado para ajudar operários a transportar sacos de cimento do alto de uma plataforma para o chão.
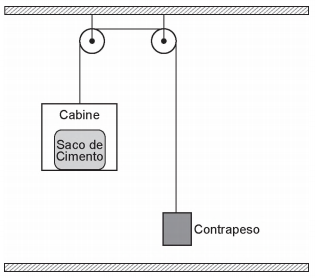
O sistema é abandonado, a partir do repouso, da posição mostrada na Figura, e a cabine desce em trajetória vertical.
Se os atritos são desprezíveis e os cabos ideais, os valores aproximados da tração na corda e aceleração da cabine, durante a descida, são, respectivamente, em N e m -s2,
Dados
aceleração da gravidade g = 10,0 m .s2;
massa do contrapeso = 25,0 kg;
massa da cabine = 5,00 kg;
massa do saco de cimento = 50,0 kg.
Os hidrocarbonetos representados a seguir, e identificados por I, II e III, são compostos orgânicos relativamente simples, pois são constituídos exclusivamente por átomos de carbono e hidrogênio.
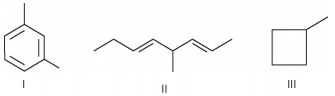
Os compostos I, II e III correspondem aos tipos
Considere as seguintes equações químicas de oxirredução balanceadas a seguir:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO 2(s) (I)
2 K(s) + 2 H2O(ℓ) → 2 KOH(aq) + H2(g) (I)
2 NaBr(aq) + Cℓ2(g) → 2 NaCℓ(aq) + Br2(ℓ) (III)
Em cada uma das equações, o agente oxidante é a espé
cie química:
As substâncias inorgânicas possuem diversas aplicações: o Aℓ2(SO4)3 é utilizado em uma das etapas do tratamento de água, o H2SO4 é matéria-prima para produção de fertilizantes, o Aℓ (OH)3 é empregado em medicamentos, e o Aℓ2O3 é utilizado na fabricação de materiais cerâmicos.
A respeito dessas substâncias, verifica-se que o
Policaprolactona, cuja sigla é PCL, é um polímero biodegradável muito utilizado como aditivo em resinas, e acrilonitrila-butadieno-estireno, cuja sigla é ABS, é um polímero que possui elevada resistência, portanto, é utilizado na fabricação de capacetes, entre outros objetos.
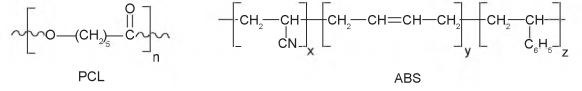
PCL e ABS são, respectivamente:
Uma solução aquosa de bicarbonato de sódio (NaHCO3) foi preparada em um balão volumétrico de 250,00 mL utilizando-se 10,0 g do soluto, com o volume final ajustado pela adição de água pura. Dessa solução foi retirada uma alíquota de 25,00 mL, que foi transferida para um balão de 100,00 mL, no qual o volume final foi ajustado pela adição de água pura.
Os valores mais próximos das concentrações, em quantidade de matéria (mol L-1), da solução inicial e da solução após a diluição são, respectivamente,
Dado
M (NaHCO3) = 84,0 g mol-1
O tricloreto de fósforo (PCℓ3) é um composto químico muito utilizado como matéria-prima para obtenção de diversos compostos organofosforados. Ele é comumente preparado, sob condições adequadas, de acordo com a equação química balanceada representada a seguir.
P4(s) + 6 Cℓ2(g) → 4 PCℓ3(l)
O valor mais próximo da massa, em gramas, de PCℓ3 que se formaria a partir de 12,4 g de P4 e 30,0 g de Cℓ2, considerando um rendimento de 100%, seria
Dados
M (P4) = 123,9 g mol-1
M (Cℓ2) = 70,9 g mol-1
M (PCℓ3) = 137,3 g mol-1
Um vaso de 3 m3 contendo uma mistura de hidrocarbonetos, hermeticamente fechado, opera inicialmente a 3 x 105 Pa. Sem haver entrada ou saída de material, o vaso sofre uma remoção de calor de 895 kJ, mediante um sistema de resfriamento, tendo sua pressão reduzida para 2,8 x 105 Pa.
Nessa condição, a variação da entalpia do vaso, em kJ, foi de
Um feirante sabe que consegue vender seus produtos a preços mais caros, conforme o horário da feira, mas, na última hora, ele deve vender suas frutas pela metade do preço inicial. Inicialmente, ele vende o lote de uma fruta a R$ 10,00. Passado algum tempo, aumenta em 25% o preço das frutas. Passado mais algum tempo, o novo preço sofreu um aumento de 20%. Na última hora da feira, o lote da fruta custa R$ 5,00.
O desconto, em reais, que ele deve dar sobre o preço mais alto para atingir o preço da última hora da feira deve ser de