Questões de Vestibular
Sobre calor sensível em física
Foram encontradas 22 questões
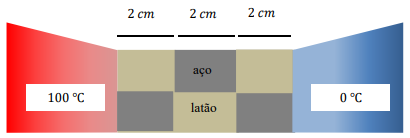
Uma massa de água no estado sólido, inicialmente à temperatura de –10 ºC, é aquecida até atingir a temperatura final de 80 ºC. Considere que todo o processo tenha ocorrido à pressão constante de 1,0 atm e que essa massa de água tenha recebido um total de 16500 cal para o processo térmico. Sem levar em conta os efeitos de sublimação do gelo para temperaturas abaixo de 0 ºC, assuma que o valor para o calor específico do gelo seja de 0,5 cal/g ºC, que o calor específico da água seja 1,0 cal/g ºC e que o calor latente de fusão do gelo seja de 80,0 cal/g.
Nesse caso, a massa de água aquecida, em gramas, durante o processo é de
Uma quantidade de calor Q = 56.100,0 J é fornecida a 100 g de gelo que se encontra inicialmente a -10 °C.
Sendo
o calor específico do gelo cg = 2,1 J/(g°C),
o calor específico da água ca = 4,2 J/(g°C) e
o calor latente de fusão CL = 330,0 J/g,
a temperatura final da água em °C é,
aproximadamente,
Ele obteve para esses valores, respectivamente,
No final do processo, a temperatura da água resultante do equilíbrio térmico foi igual a
Uma piscina oficial olímpica tem as dimensões: 50m de comprimento, 25m de largura e 3m de profundidade. Para se evitar a proliferação de microorganismos é recomendado um pH acido.
Considerando a densidade da água limpa como 1000 Kg para cada 1,0 m3 e o seu calor específico como 4180J/kg°C, ASSINALE a alternativa que contém a energia necessária para elevar em 1,0°C toda a água de uma piscina olímpica e o procedimento que torna a água mais ácida.
Considere duas garrafas idênticas, uma
contendo 1 kg de leite e outra contendo 1 kg de
água, ambas inicialmente a 15 °C e expostas à
temperatura ambiente de 21 °C. A capacidade
térmica do leite integral é, aproximadamente, 3,93
kJ·K-1
·kg-1 e da água é 4,19 kJ·K-1
·kg-1
. Considere
que a condutividade e a emissividade térmica sejam
as mesmas para os dois líquidos. Com base nessas
informações, é correto afirmar que, ao atingir o
equilíbrio térmico com o ambiente,
Dados: dágua = 1,0 g/cm3 ; dgelo = 0,9 g/cm3 ;
calor latente de fusão do gelo = 80 cal/g;
calor específico da água = 1 cal/gºC e
pressão atmosférica = 1 atm.
Dados: calor específico da água c = 1 cal/g ºC densidade da água d = 1 000 g/L Obs.: considerar 1 cal = 4 J.
Para determinar o valor energético de um alimento, podemos queimar certa quantidade desse produto e, com o calor liberado, aquecer determinada massa de água. Em seguida, mede-se a variação de temperatura sofrida pela água depois que todo o produto foi queimado, e determina-se a quantidade de energia liberada na queima do alimento. Essa é a energia que tal alimento nos fornece se for ingerido.
No rótulo de um pacote de castanha-de-caju, está impressa a tabela a seguir, com informações nutricionais sobre o produto.
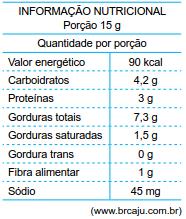
Considere que 150 g de castanha tenham sido queimados e que determinada massa m de água, submetida à chama dessa combustão, tenha sido aquecida de 15 ºC para 87 ºC. Sabendo que o calor específico da água líquida é igual a 1 cal/(g · ºC) e que apenas 60% da energia liberada na combustão tenha efetivamente sido utilizada para aquecer a água, é correto afirmar que a massa m, em gramas, de água aquecida era igual a
Os cálculos dos pesquisadores sugerem que a temperatura média dessa estrela é de Ti = 2.700 0C. Considere uma estrela como um corpo homogêneo de massa M = 6,0 x 1024 kg constituída de um material com calor específico c = 0,5 kJ/(kg °C). A quantidade de calor que deve ser perdida pela estrela para que ela atinja uma temperatura final de Tf = 700 °C é igual a

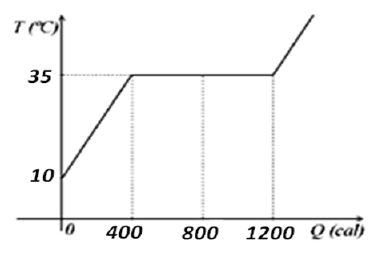
Observando-se o Gráfico, pode-se concluir que a quantidade de calor necessária para liquefazer a massa de 1,0g de água e elevar sua temperatura de 0o C até 100o C é, respectivamente,
Na superfície da Terra, em altitudes próximas ao nível do mar, os estados físicos da água estão diretamente relacionados à sua temperatura conforme mostrado no Gráfico ao lado. Esse Gráfico representa o comportamento de uma massa de 1,0 g de gelo a uma temperatura inicial de - 50o C, colocada em um calorímetro que, ligado a um computador, permite determinar a temperatura da água em função da quantidade de calor que lhe é cedida.
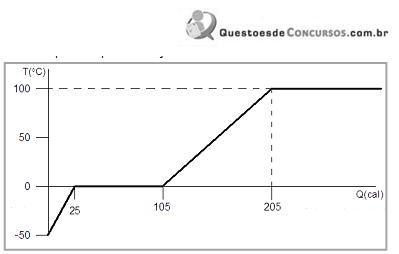
Observando-se o Gráfico, pode-se concluir que a quantidade de calor necessária para liquefazer a massa de 1,0g de água e elevar sua temperatura de 0 °C até 100 °C é, respectivamente,