Questões de Vestibular de Química - Cinética Química
Foram encontradas 268 questões
O níquel é empregado na indústria como catalisador de diversas reações, como na reação de reforma do etileno glicol, que produz hidrogênio a ser utilizado como combustível. O processo ocorre num tempo muito menor quando é utilizado 1 g de níquel em uma forma porosa desse material, em comparação à reação utilizando uma única peça cúbica de 1 g de níquel. Abaixo está esquematizada a equação de reforma do etileno glicol e ao lado uma imagem de microscopia eletrônica de uma amostra de níquel na forma porosa.
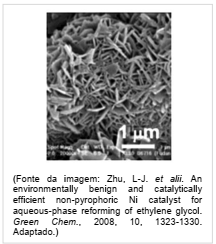
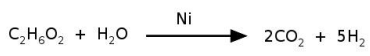
Nas condições mencionadas, a reação de reforma ocorre num tempo menor
quando usado o níquel poroso porque:
A figura a seguir mostra o diagrama de energia da reação A+B→C, ocorrendo via caminho 1 (linha sólida) ou 2 (pontilhado).
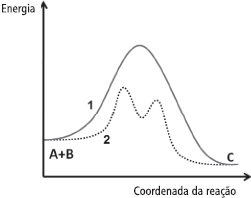
Com base no diagrama, analise os itens a seguir:
I) Existe a formação de um intermediário de reação no caminho 2.
II) Apenas um estado de transição (complexo ativado) está presente no caminho 1.
III) A reação deve se processar mais rapidamente, se ocorrer pelo caminho 1.
IV) O caminho 2 pode representar a reação A+B→C,na presença de um catalisador.
Estão corretos os itens:
C6H12O6 → 2 C2H5OH + 2 CO2
Considerando um processo de conversão com eficiência de 85%, qual será a massa de etanol obtida da fermentação de 100 kg de glicose? (Massa molar (g/mol): C = 12,0; H = 1,0; O = 16,0)
O ácido hidrazoico HN3 é um ácido volátil e tóxico que reage de modo extremamente explosivo e forma hidrogênio e nitrogênio, de acordo com a reação abaixo.
2 HN3 → H2 + 3 N2
Sob determinadas condições, a velocidade de decomposição do HN3 é de 6,0 x 10 –2 mol L – 1 min – 1
Nas mesmas condições, as velocidades de
formação de H2 e de N2 em mol L – 1 min – 1
, são,
respectivamente,