Questões de Vestibular
Sobre cinética química em química
Foram encontradas 266 questões
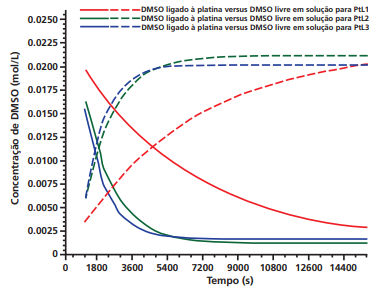
Considerando que quanto menor a velocidade de troca, maior é a eficiência do fármaco, pode-se concluir que
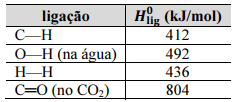
Considerando que a reação envolvida na reforma a vapor do metano apresente cinética de primeira ordem em relação ao metano, assinale a opção em que é apresentado gráfico que melhor representa a variação da pressão parcial de H2 no sistema em função do tempo de reação.
A velocidade de conversão de SO2 atmosférico em SO3 é diretamente proporcional à concentração do radical hidroxilo na atmosfera.
As empresas farmacêuticas utilizam diferentes tecnologias para permitir a liberação controlada. Em alguns casos, por exemplo, o medicamento possui um revestimento que se dissolve depois de um período para liberar as partículas de fármaco. O revestimento tem por objetivo controlar a velocidade da reação e liberar uniformemente o fármaco no organismo.
Considerando o texto apresentado, assinale V (verdadeiro) ou F (falso) para as afirmações a seguir.
( ) Um fármaco constituído de partículas menores é absorvido mais lentamente pelo organismo do que outro com partículas maiores. ( ) A área superficial em um medicamento sólido na forma de pó é maior do que a área superficial em um medicamento na forma de comprimido. ( ) Quanto maior a espessura do revestimento do fármaco, maior o tempo para o fármaco ser absorvido pelo organismo.
O correto preenchimento dos parênteses, de cima para baixo, é
2N α2O2(s) + 2H2O(l) → 4N aOH(s) + O2(g)
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O
Considerando as informações anteriores, julgue o item.
Sabendo que a reação em tela tem a sua velocidade
aumentada na presença da enzima invertase extracelular, é
correto inferir que essa enzima funciona como catalisador de
uma das etapas da fermentação da sacarose realizada pelo
Aspergillus niger.
Essa aparente contradição pode ser explicada pois
O gráfico a seguir representa corretamente a reação de combustão da madeira usada na queima da argila para a formação da cerâmica.
As reações de hidrólise de ésteres, quando realizadas em meio aquoso, podem ser catalisadas pela adição de ácido, sendo a reação mais lenta em meios próximos da neutralidade.
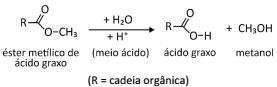
Duas reações idênticas para a hidrólise desse éster foram
realizadas nas mesmas condições, variando apenas o pH do
meio: uma delas foi conduzida em pH=2 e outra em pH=6. Qual
dos seguintes diagramas representa de forma mais adequada a
quantidade de ácido graxo formada em função do tempo de
reação para as hidrólises em pH=2 e pH=6?
CO(g) + NO2 (g) ➔ CO2 (g) + NO(g)
A reação teve sua cinética estudada e os dados obtidos em alguns experimentos estão indicados na tabela abaixo
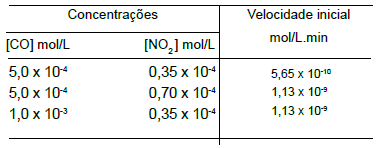
Em relação ao que foi descrito, é correto concluir que a reação apresenta
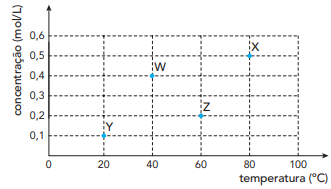
A maior velocidade inicial de formação de gás hidrogênio foi verificada no seguinte experimento:
1. Colocou-se 10 mL de detergente líquido em uma proveta de capacidade de 100 mL. 2. Adicionou-se, na proveta, 10 mL de água oxigenada 30% e agitou-se com um bastão de vidro. 3. Após a agitação, adicionou-se alguns cristais do iodeto de potássio e, imediatamente, de uma forma acelerada, formou-se uma grande quantidade de espuma, transbordando a proveta.
Com relação a essa experiência, é correto afirmar que
A reação de decomposição do ozônio é representada pela equação a seguir:
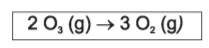
Num dado experimento de decomposição do ozônio, observou-se a variação da concentração molar de O3 em função do tempo, demonstrada no quadro abaixo.

Analisando os dados experimentais, a velocidade
média de produção de gás oxigênio (O2), em
mol/L.minuto, nos 3 minutos iniciais da reação é:
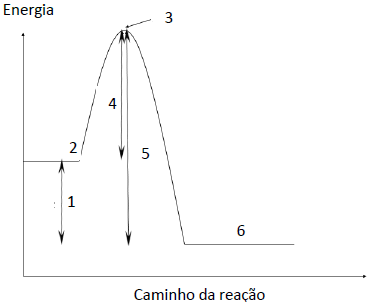
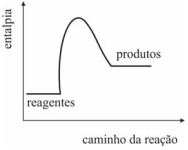
Energia de ativação, variação de entalpia da transformação e complexo ativado podem ser, respectivamente, associados aos números
I. A velocidade de uma reação é uma grandeza que indica como as quantidades de reagentes e produtos dessa reação variam em uma escala temporal. II. A velocidade das reações química depende da concentração dos reagentes. III. Quanto maior for a concentração de reagentes, menor será a velocidade das reações químicas. IV. Em uma reação química, a energia de ativação corresponde ao valor mínimo de energia que as moléculas de reagentes devem possuir para que seja eficaz uma colisão entre elas. V. O valor específico da energia de ativação em uma reação química é uma constante comum a todos os tipos de reações que podem ocorrer. VI. O aumento da temperatura, em uma reação química, contribui para o aumento da velocidade desta reação. VII. Uma substância caracterizada como catalisadora, aumenta a velocidade de uma reação química e, portanto, será, sem exceções, consumida durante a reação. VIII. Um catalisador aumenta a velocidade de uma reação química, pois promove aumento da energia de ativação da mesma. IX. Em uma reação química, a alteração na velocidade devido à ação de um catalisador é denominado catálise.
Na correção dessas afirmações feitas pelo aluno na prova, o professor descontou 2 pontos por cada afirmação incorreta. Sendo assim, pode-se considerar que foi descontado na prova do referido aluno:

Adaptado de: http://repositorio.unicamp.br/jspui/handle/REPOSIP/248833 (Acesso em: 22/04/2019).
Pela análise dos dados são feitas as seguintes afirmativas:
I. A energia de ativação da reação é menor quando é adicionado o íon Mn2+.
II. A energia de ativação da reação aumenta quando a temperatura é aumentada.
III. A reação tem sua velocidade diminuída com o aumento da temperatura.
IV. A celulose é um polissacarídeo formado pela ligação entre moléculas de glicose.
Estão corretas apenas as afirmativas
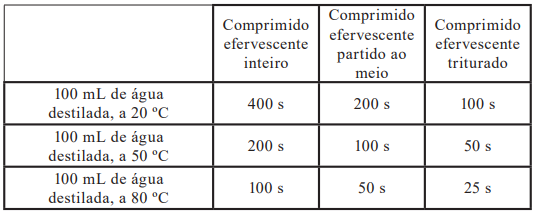
Após a leitura dos resultados, esse estudante fez as seguintes proposições:
I. Quanto maior a superfície de contato entre os reagentes, maior será a velocidade da reação, independentemente da temperatura em que foi realizado experimento. II. O aumento de 30 ºC na temperatura da água faz com que a velocidade da reação seja duplicada para um comprimido em que não haja a variação na sua superfície de contato. III. Quanto maior a temperatura da água destilada, maior será a velocidade da reação. Se a superfície de contato entre os reagentes também aumentar, a velocidade da reação também irá aumentar.
É correto afirmar que
I. Um catalisador aumenta o rendimento de uma reação. II. No momento em que ocorre o choque entre as partículas em uma posição favorável, forma-se uma estrutura intermediária entre os reagentes e os produtos denominada complexo ativado. III.O valor da energia de ativação é independente da presença de catalisador.
Está(ão) correta(s) a(s) afirmativa(s)
Uma possibilidade de realização dessa reação usa persulfato, tiossulfato e iodeto, e, nesse caso, uma das etapas é a reação entre o íon persulfato (S2O8 2 -) e o íon iodeto (I-), cuja velocidade de decomposição do persulfato foi determinada e encontra-se na tabela abaixo.
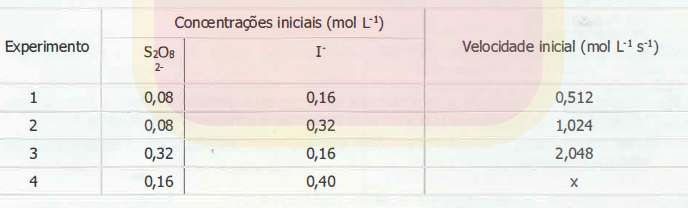
Assinale a alternativa que apresenta a velocidade inicial x do experimento 4, em mol L-1 s-1, tendo em vista as condições expressas acima.
