Questões de Vestibular
Sobre cinética química em química
Foram encontradas 267 questões
Equação 1: 3C2H6(g) + 2HgO(s) + 5/2 O2(g) → 2(CH3)2Hg(g) + 2CO2(g) + 3H2O(g)
Equação 2: 3C2H5OH(g) + HgO(s) + 5O2(g) → (CH3)2Hg(g) + 4CO2(g) + 6H2O(g)
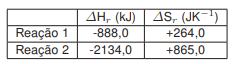
Com base no texto, nos conhecimentos sobre termodinâmica e cinética química, e supondo a queima total de HgO a 1 atm e a 300 K, assinale a alternativa correta.
Sobre catalisadores, são feitas as quatro afirmações seguintes.
I. São substâncias que aumentam a velocidade de uma reação.
II. Reduzem a energia de ativação da reação.
III. As reações nas quais atuam não ocorreriam nas suas ausências.
IV. Enzimas são catalisadores biológicos.
Com base nos conhecimentos sobre cinética química, dentre as afirmações apresentadas estão corretas:
Para responder à questão, analise os seguintes dados:
1- A temperatura ao final da reação é de 70°C.
2- Considere que esta reação ocorra numa estufa e que a velocidade de formação do produto dentro da estufa seja de 2,5 mol ⁄ L. seg.
Aplicando-se a regra de van’t Hoff, a velocidade de uma reação química que inicialmente se encontra submetida a uma temperatura de 30°C equivale a
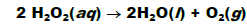
Na presença do íon brometo (Br- ), a decomposição ocorre rapidamente segundo as reações:
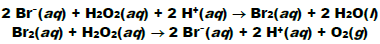
As reações vistas podem ser demonstradas graficamente a partir de um diagrama de energia potencial:
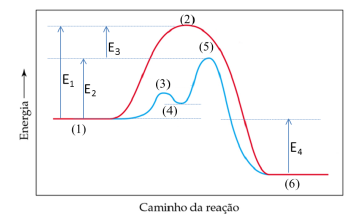
Em relação à decomposição do H2O2:
I. A reação sem catalisador acontece em apenas uma etapa e a reação com catalisador acontece em duas etapas, porém o produto formado é exatamente o mesmo.
II. E1 é a energia de ativação referente à decomposição do H2O2 na ausência de catalisador e E3 é a energia de ativação referente à decomposição do H2O2 na presença de catalisador. III. E2 é a energia de ativação da etapa determinante da velocidade da reação catalisada pelo íon Br- .
IV. E4 é a variação de entalpia da reação, que é endotérmica.
V. No gráfico, os pontos identificados por (2), (3) e (5) correspondem à energia dos complexos ativados para as reações representadas.
Assinale a alternativa CORRETA.
I. o aumento da concentração dos reagentes diminui a velocidade da reação.
II. quanto maior a área de contato entre as fases dos reagentes, maior será a velocidade da reação.
III. quanto maior a energia de ativação, mais lenta será a reação.
IV. o aumento da temperatura do sistema diminui a velocidade da reação.
V. o uso de catalisador diminui a energia de ativação e, portanto, aumenta a velocidade de uma reação.
Assinale a alternativa CORRETA.
Numa determinada condição experimental e com o catalisador adequado, ocorre uma reação, conforme representada no gráfico, que relaciona porcentagem do composto pelo tempo de reação.
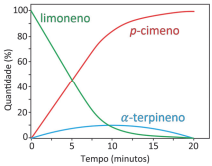
Uma representação adequada para esse processo é:
Com relação a princípios da química, julgue o próximo item.
Situação hipotética: Durante um experimento, um refrigerante, a uma temperatura T1, foi colocado em um copo; em seguida, outro refrigerante (de marca mesma), a uma temperatura T2, foi colocado em outro copo. Formaram-se bolhas em ambos os refrigerantes assim que estes foram despejados nos copos, mas a quantidade de bolhas formadas no refrigerante sob a temperatura T1 foi menor que a quantidade de bolhas formadas no refrigerante sob a temperatura T2. Assertiva: Nessa situação, depreende-se que T1 é maior que T2.
A química explica o fato de que reações de decomposição alimentos são retardadas quando eles ficam armazenados em geladeiras.
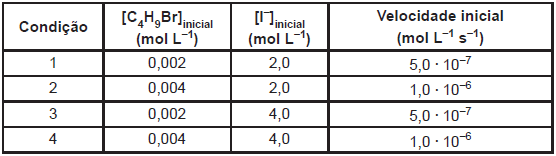
Sobre a cinética dessa reação, assinale a alternativa CORRETA.
Analise o esquema.
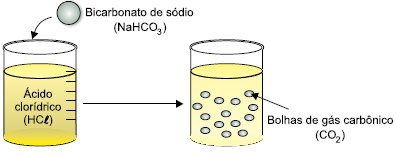
Admita que a reação ocorrida seja instantânea.
Se a velocidade de consumo do bicarbonato de sódio foi
2,5 × 10–3
mol/L × s, a velocidade de formação do gás carbônico foi de
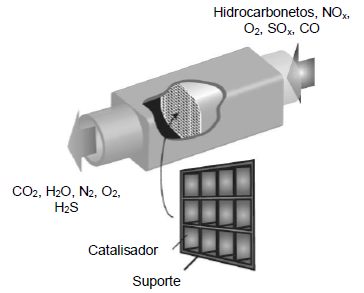
Figura adaptada de Duward Shriver et al., Inorganic Chemistry, 6 ed., 2014.
Sobre o processo de catálise ilustrado acima, é correto afirmar o que segue
(CH3)3CBr(aq) + OH- (aq) → (CH3)3COH(aq) + Br- (aq)
Experimentos foram realizados para o estudo da cinética reacional, à temperatura constante de 60°C.
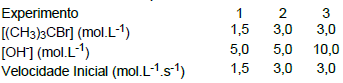
Baseado nos experimentos descritos acima, qual a lei de velocidade para a formação do terc-butanol?
1) A velocidade de uma reação química geralmente diminui com o aumento da temperatura.
2) A velocidade de uma reação química depende da concentração dos reagentes.
3) A velocidade de uma reação química independe da orientação apropriada das moléculas no momento do choque.
4) Para os sólidos, quanto maior a superfície de contato, maior será a velocidade da reação química.
Estão corretas apenas:
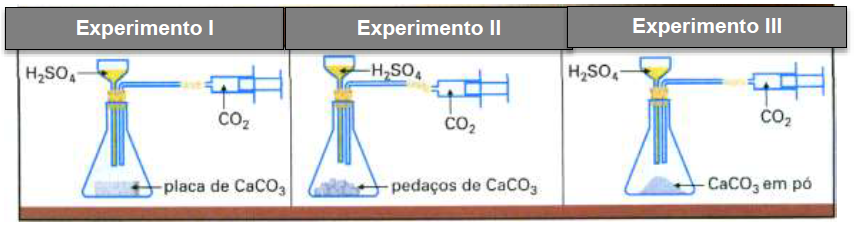 http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/Figuras/influ
encia/infl001.gif. Acesso em 12.fev.2019.
http://www.marco.eng.br/cinetica/trabalhodealunos/CineticaBasica/Figuras/influ
encia/infl001.gif. Acesso em 12.fev.2019. Os experimentos ilustrados utilizaram, nas três situações, quantidades iguais de massa de carbonato de cálcio e mesma concentração e volumes de ácido sulfúrico. Na seringa, foi coletado o gás carbônico como um dos produtos dessa reação.
A partir desses experimentos, deduz-se que, após reação total nos três casos,
