Questões de Vestibular
Sobre cinética química em química
Foram encontradas 270 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Catalisadores são agentes que aumentam as velocidades das reações, afetando os tipos de colisões (mecanismos) que levam à reação.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O aumento da temperatura faz aumentar a energia das moléculas e, à medida que as moléculas movem-se mais velozmente, elas se chocam com maior frequência e também com energia mais alta, ocasionando um aumento na velocidade da reação.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Para reações que envolvem líquidos, o aumento na concentração de um dos reagentes leva a um aumento na velocidade da reação, pois, conforme se aumenta a concentração, aumenta-se também a frequência com a qual as moléculas se chocam. Isto é válido desde que o reagente em questão faça parte da lei de velocidade.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Reações que envolvem sólidos tendem a prosseguir mais rapidamente se a área superficial dos sólidos for diminuída. Isso pode ser feito diminuindo-se o tamanho das partículas dos sólidos.
I. A reação que ocorre pelo caminho A é mais lenta, sem catalisador e com energia de ativação (Ea ) maior. II. A reação que ocorre pelo caminho B é mais rápida, com catalisador, sendo as energias de ativação das duas etapas (Ea1 e Ea2) menores. III.As reações que ocorrem pelo caminho A e B possuem a variação de entalpia (ΔH) > 0, portanto são endotérmicas. IV.As reações que ocorrem pelo caminho A e B possuem a variação de entalpia ( ΔH) < 0, portanto são exotérmicas. V. As reações que ocorrem pelo caminho A e B possuem velocidades iguais, pois o produto final tem a mesma energia.
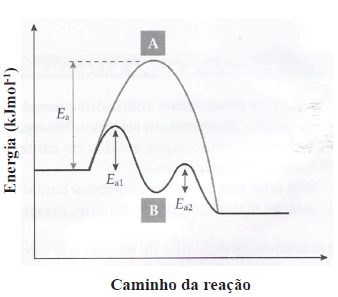
Marque a opção correta
A seguinte equação química representa a combustão da amônia:
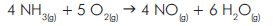
Sabendo-se que a amônia estava sendo queimada a
uma velocidade de 0,48 mol.L-1
.s-1
, qual a velocidade
de consumo do gás oxigênio?
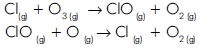
Por isso, o cloro atômico age como
I. a velocidade média das moléculas reagentes. II. a energia cinética média das moléculas dos reagentes. III. a frequência das colisões entre as moléculas dos reagentes.
Das afirmações
A lei da velocidade para a reação hipotética é fornecida pela equação
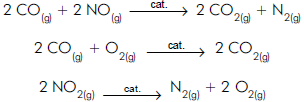
Das seguintes afirmações acerca dessas reações:
I São todas de catálise heterogênea.
II Os catalisadores são consumidos nas reações.
III Os catalisadores aumentam a superfície de contato entre os reagentes.
IV Baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que somente a

Partindo da equação química ajustada e estabelecendo um consumo de 1,5 mols de pentano em 30 minutos de reação, pode-se concluir que a velocidade da reação, em mols de gás carbônico por minuto, é



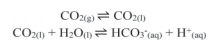
Sabe-se que depois de aberto, o refrigerante vai progressivamente perdendo seu sabor característico. Uma das formas de diminuir a velocidade desse processo é manter a bebida em baixas temperaturas. Essa ação é eficaz porque em baixas temperaturas:
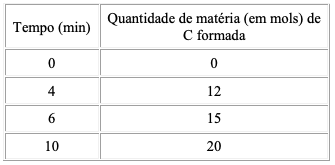
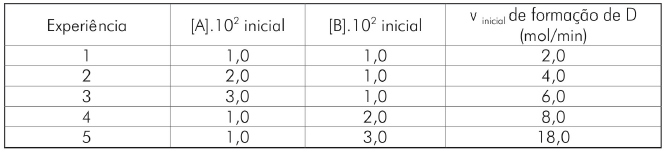
A partir da análise da tabela, assinale a afirmativa correta.
Um exemplo típico dessa colaboração é o uso, nos conversores catalíticos dos automóveis, de catalisadores, cuja função, nessa situação, é aumentar a velocidade da reação de poluentes produzidos pela combustão, transformando-os em substâncias menos poluentes, uma vez que
Para calcular a velocidade de uma reação, podemos medir a quantidade de reagentes consumidos ou a quantidade de produtos formados por unidade de tempo. A figura abaixo representa um experimento no qual misturou-se 50 mL de uma solução de ácido clorídrico 0,1 mol L-1 com um grama de magnésio metálico. Observe o gráfico do volume do gás Hidrogênio formado versus tempo.

Para calcular a velocidade de uma reação, podemos medir a quantidade de reagentes consumidos ou a quantidade de produtos formados por unidade de tempo. A figura abaixo representa um experimento no qual misturou-se 50 mL de uma solução de ácido clorídrico 0,1 mol L-1 com um grama de magnésio metálico. Observe o gráfico do volume do gás Hidrogênio formado versus tempo.

I - No instante t = 60 s, a velocidade da produção do gás hidrogênio é maior que a velocidade de consumo de Mg (em mols/s).
II - Em qualquer instante após o início da reação, a quantidade de matéria (mol) produzida de gás hidrogênio é o dobro da consumida de ácido clorídrico.
III - A massa de gás hidrogênio produzida é sempre menor que a massa de ácido consumida, em qualquer instante.
Está(ão) correto(s):
O acendimento instantâneo do palito de fósforo antigo era possível por que a reação entre fósforo branco e oxigênio possui:

Os dados apresentados na tabela foram obtidos a partir de experimentos feitos com a reação de cloreto de iodo, ICl(g) e hidrogênio, H2(g), a determinada temperatura.
Uma análise desses dados permite inferir:
Para reciclar sucata de alumínio, basta aquecê-la até a temperatura de fusão do alumínio, que é de 660°C. O alumínio derretido é transformado em lingotes, que são vendidos às indústrias que o usam. Às vezes, vem ferro junto com o alumínio. Para separá-lo, usa-se um ímã, antes de jogar a sucata de alumínio no forno de fusão. Quando a sucata de alumínio é de latas de refrigerante, a gente precisa prensar um monte de latas para formar um pacote menor. É que as latas são de alumínio muito fino e na temperatura do forno de fusão seriam atacadas pelo oxigênio do ar. O alumínio formaria óxido de alumínio e perderíamos todo o alumínio. Quando as latas estão prensadas, o oxigênio não chega lá tão facilmente e o alumínio derrete antes de ser atacado pelo oxigênio.
Texto adaptado: Tele-curso 2000, Química, Aula 24.
Do ponto de vista da Cinética, prensar as latas de alumínio diminui a velocidade da reação porque diminui