A reação de decomposição do ozônio é representada pela equa...
A reação de decomposição do ozônio é representada pela equação a seguir:
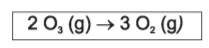
Num dado experimento de decomposição do ozônio, observou-se a variação da concentração molar de O3 em função do tempo, demonstrada no quadro abaixo.

Analisando os dados experimentais, a velocidade
média de produção de gás oxigênio (O2), em
mol/L.minuto, nos 3 minutos iniciais da reação é:
- Gabarito Comentado (1)
- Aulas (5)
- Comentários (3)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Esta questão
aborda conceitos relacionados à cinética química.
A velocidade
média de uma reação química pode ser determinada através da divisão entre a
variação da concentração (∆C) pelo tempo de reação (∆t):
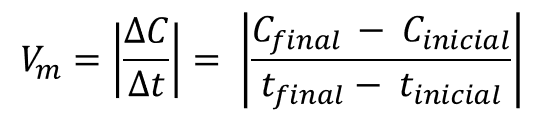
A velocidade
média também pode ser obtida de acordo com o consumo ou a formação das
substâncias de determinada reação. Considerando a reação genérica abaixo, a expressão
da velocidade é dada a partir da velocidade de cada substância, dividido pelo respectivo
coeficiente estequiométrico:
aA + bB → cC + dD

Analisando o
enunciado, temos a seguinte reação:
2 O3 (g) → 3 O2 (g)
Com base no
exposto, de acordo com os dados do enunciado para a reação de formação do gás
oxigênio (O2), é preciso primeiramente calcular a velocidade média
de consumo do ozônio (O3). Essa velocidade pode ser calculada a
partir da razão entre a variação da concentração dessa substância (∆C) e a variação
do tempo (∆t), conforme expressão abaixo:
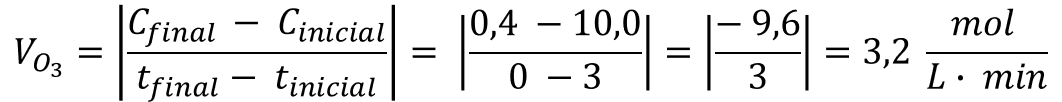
Com a velocidade de consumo do O3 é possível calcular a velocidade de formação do O2, de acordo com a expressão mostrada acima, relacionando as duas velocidades e os respectivos coeficientes estequiométricos:
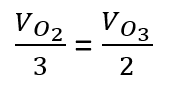
Substituindo
os dados, temos que:
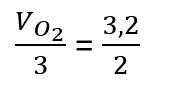
Logo:
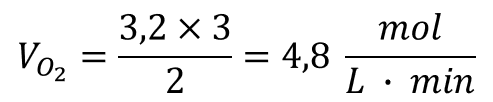
Gabarito da Professora: Letra C.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
O oxigênio é produzido com velocidade 1.5x que o ozônio é consumido.
Pelo gráfico, temos que o tempo de consumo de ozônio é
V = |0.4-10|/3 = 3,2 mol/min
Como a velocidade do oxigênio é 1.5x maior, então temos que 3,2 x 1.5 = 4,8 mol/min
"C"
a razão entre a velocidade de consumo é de 3/2 = 1,5
V= quantidade de matéria / tempo
v= 0,4 - 10 / 3
v= 3,2
mas a velocidade do oxigênio é 1.5x maior, vai ficar 3,2 x 1,5 = 4,8
V=|Δ concentração| /tempo
V = |0,4 - 10|/3 = 3,2 mol/L.min
Como a constante é de 1,5 do reagente em relação ao produto fazemos a multiplicação:
1,5 x 3,2 = 4,8mol/L.min
letra C)
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo