Questões de Vestibular de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 420 questões
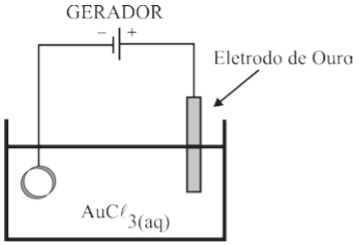
Dados: Au = 197 g/mol e 1 mol de elétrons = 9,6∙104 C.
A respeito do processo eletroquímico ilustrado acima, considere as afirmações dadas, de I a V.
I. O anel foi colocado no ânodo da cuba eletrolítica.
II. Ao passar uma corrente de 3 ampères, durante 16 minutos, há a deposição de aproximadamente 2,0 g de ouro sobre o anel.
III. No polo positivo ocorre a reação Au(s) → Au3+(aq) + 3 e-.
IV. No cátodo da cela eletrolítica ocorre oxidação.
V. No anel ocorre a reação Au3+(aq) + 3 e- → Au(s).
Dessas afirmações, estão corretas, somente
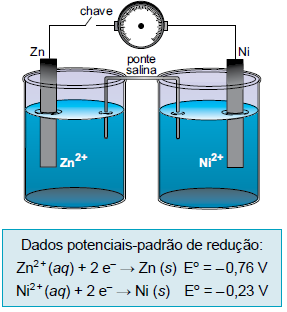
O catodo e a diferença de potencial da pilha são, respectivamente,
O cloreto de bário, BaCl2(s), é um composto químico tóxico, de temperatura de fusão 962°C, que deve ser manipulado com cuidado porque, quando inalado, pode causar lesões no cérebro e problemas intestinais. Esse sal é utilizado na produção de gás cloro, Cl2(g), por eletrólise ígnea, de acordo com as transformações representadas, de maneira simplificada, pelas semi-equações na tabela.
Considerando-se essas informações e os conhecimentos sobre eletroquímica, é correto afirmar:
Considerando-se as informações do texto associadas aos conhecimentos sobre soluções aquosas, é correto afirmar: