Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões

I. Co3+(aq) + e‒ → Co2+(aq) 1,82
II. Cu2+(aq) + 2e‒ → Cu(s) 0,34
III. Sn2+(aq) + 2e‒ → Sn(s) ‒ 0,14
IV. Na+ (aq) + e‒→ Na(s) ‒ 2,71
Assinale a opção em que a reação de oxidação-redução de duas dessas semirreações são espontâneas.
Na reação em tela, ocorre a oxidação do arsênio de um estado de oxidação +3 para um +5.
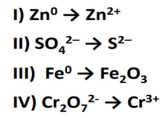
DADOS QUE PODEM SER USADOS

Para a geração de 36 mg de H2 por hora a partir da eletrólise da água, a corrente elétrica média necessária deverá ser superior a 0,80 A.
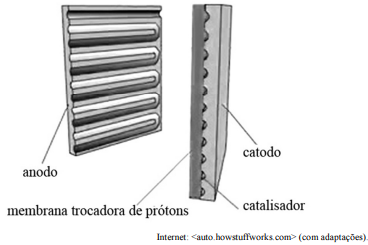
Tendo o texto precedente como referência inicial, julgue o item.
Na célula a combustível, a função do catalisador é reagir com os íons hidrogênio, com a molécula de oxigênio e com os elétrons recebidos do anodo para gerar energia.

Tendo o texto precedente como referência inicial, julgue o item.
A reação eletroquímica que ocorre em uma célula a combustível produz CO2 e H2O.

Tendo o texto precedente como referência inicial, julgue o item.
Na reação que ocorre na célula a combustível, o hidrogênio é o agente oxidante e o oxigênio, o agente redutor.

Tendo o texto precedente como referência inicial, julgue o item.
As semirreações que ocorrem no anodo e no catodo são apresentadas a seguir, conforme as informações do texto.
anodo: 2 H2 → 4 H+ + 4 e−
catodo: O2 + 4 H+ + 4 e− → 2 H2O
Em seu estado fundamental de energia, o átomo de níquel neutro possui elétrons desemparelhados.
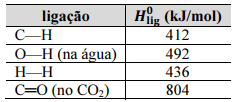
No processo de reforma a vapor do metano, a separação do H2 a partir da mistura reacional pode ser realizada facilmente porque, após o resfriamento do sistema, a água condensará e solubilizará o H2, devido à formação de ligações de hidrogênio entre as moléculas de H2O e H2; após a remoção dos gases não dissolvidos, o H2 dissolvido na água pode ser liberado por meio de um aquecimento brando da mistura.
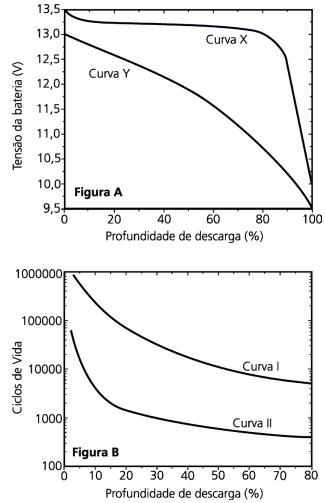
Levando em conta essas informações, seria apropriado escolher para equipar um carro

Considerando a equação do teste da glicose, é correto afirmar que

3KCℓO4 + 8Aℓ → 3KCℓ + 4Aℓ2O3 + energia luminosa
Nessa reação, o
Tendo como referência as informações precedentes, julgue o item que se segue.
Na reação III, há redução do ferro em um processo que
envolve a transferência de dois mols de elétrons por mol
de FeO.