Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

As baterias recarregáveis possuem a característica de prolongar muito sua vida útil, o que aumenta a relação custo-benefício. A bateria recarregável mais conhecida é a bateria de chumbo usada nos carros, que, por armazenar energia elétrica, é definida como bateria de armazenamento. Esse tipo de bateria consiste em seis células, cada uma gerando 2,0 V para um total de 12,0 V. A reação celular geral é dada pela seguinte equação química:
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
Sobre essa reação, é correto afirmar que
DADOS QUE PODEM SER USADOS NESTA PROVA

Ag+(aq) + e– → Ag(s) Eo = + 0,80 volts Zn2+(aq) + 2e– → Zn(s) Eo = – 0,76 volts 2H+(aq) + 2e– → H2(g) Eo = 0,00 volts Pb2+(aq) + 2e– → Pb(s) Eo = – 0,13 volts Aℓ3+(aq) + 3e– → Aℓ (s) Eo = – 1,66 volts
Considerando as semirreações e seus potenciais padrões de redução, acima apresentados, é correto afirmar que Lindalva deve escolher o vasilhame de
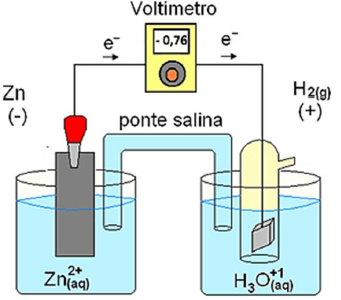
Fonte: https://mundoeducacao.uol.com.br/quimica/potencialpadrao-reducao-das-pilhas.htm. Acesso 15/05/2021.
Em relação a essa pilha, foram feitas as seguintes afirmativas:
I – Durante o funcionamento da pilha, a acidez da solução no catodo diminui. II – Ocorre oxidação da espécie Zn2+(aq). III – A semirreação de redução que ocorre na pilha é: 2H+(aq) + 2e- ➜ H2(g). IV – A força eletromotriz da pilha é dependente da concentração das espécies em solução.
Estão CORRETAS as afirmativas:
No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
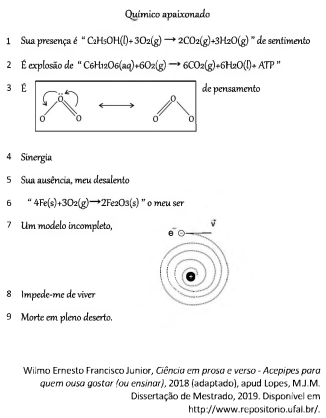
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada a corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):
Assinale a alternativa que apresenta o tempo aproximado que a célula de eletrodeposição deve ser mantida ligada, nas condições apresentadas, para que a propaganda seja verdadeira.
Dados: Massa atômica do ouro = 197 u. Constante de Faraday = 96500 C/mol de e-
Cu2+(aq) + 2e- → Cu(s) Eº = +0,34 V Fe2+ (aq) + 2e- → Fe(s) Eº = -0,44 V Zn2+(aq) + 2e- → Zn(s) Eº = -0,76 V Al3+ (aq) + 3e- → Al(s) Eº = -1,66 V
Considerando os potenciais padrão de redução apresentados, avalie as sentenças abaixo e assinale aquela quimicamente INCORRETA quanto ao processo de corrosão.
A tradição de produzir joias e semi joias em Juazeiro do Norte vem desde os tempos do Padre Cícero. Como a cidade recebia muitos visitantes para casar e não tinham alianças, surgiam daí as primeiras oficinas de joias. A galvanoplastia utiliza a eletrolise em meio aquoso para cobrir uma determinada peça metálica com outro metal. Na prateação (Ag + ) de uma aliança, fez-se passar pelas células uma corrente de 3,72 ampères durante 20 minutos. Qual a massa de prata, depositada na superfície da aliança. Dados Ag = 108
Analise as reações.
Reação 1 – Obtenção de água sanitária
Cℓ2 (g) + 2NaOH (aq) → NaCℓ O (aq) + NaCℓ (aq) + H2O (ℓ)
Reação 2 – Reação de carga de uma bateria chumbo/ácido
2PbSO4 (s) + 2H2O (ℓ) → Pb (s) + PbO2 (s) + 2H2SO4 (aq)
Reação 3 – Combustão de magnésio metálico
Mg (s) + 1/2 O2 (g) → MgO (s)
Reação 4 – Obtenção de cal
CaCO3 (s) → CaO (s) + CO2 (g)
São exemplos de oxirredução, que apresentam um reagente atuando simultaneamente como oxidante e redutor, as
reações
Empregado em processos de cromação, o tríóxido de crômio, que é altamente tóxico, corrosivo e carcinogênico, é eventualmente utilizado para a produção de crômio, de acordo com a seguinte reação: 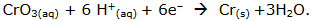
Considerando a reação acima, é correto dizer que a massa, em g, de crômio depositada por 24.125 C é,
aproximadamente
O esquema apresenta uma célula a combustível de ureia, as semirreações e seus potenciaispadrão de redução.
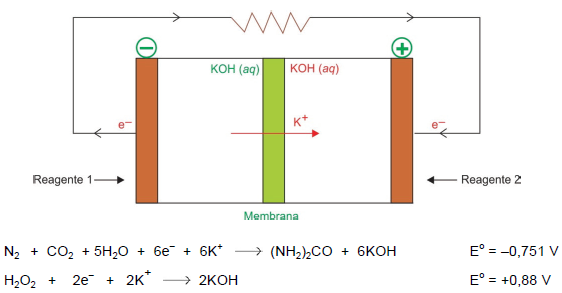
(Ke Ye et al. “Recent Advances in the electro-oxidation of urea for direct urea fuel cell and urea electrolysis”. Topics in Current Chemistry, 2018. Adaptado.)
O potencial-padrão dessa célula a combustível e todos os produtos da reação global são, respectivamente,
Semirreação Eu (V) Al3+ (aq) + 3 e- ⇌ A I (s) -1,66 Zn2+ (aq) + 2 e- ⇌ Zn (s) -0,76 Fe2+ (aq) + 2 e- ⇌ Fe (s) -0,44 Cu2+ (aq) + 2 e- ⇌ Cu (s) +0,34 Ag+ (aq) + e- ⇌ A g (s) +0,80
Com base na tabela, a afirmativa correta em relação ao processo de corrosão de metais é:
Fonte: https://ucmp.berkeley.edu/glossary/gloss3/pigments.html (acessado em 02/05/2019).
As palavras que completam as lacunas, na ordem em que se encontram no texto, são:
I. No cátodo ocorre a formação de um gás.
II. No ânodo observa-se a liberação de um gás utilizado nas estações de tratamento de água.
III. O pH da solução resultante, após a eletrólise, é menor que 7.
Está/Estão correta(s) apenas a(s) afirmativa(s)
Ered(Ag+/Ag) = 0,80 v Ered(Cu2+/Cu) = 0,34 v
O cátodo, o ânodo e o valor de ∆E0 , respectivamente, da pilha são:
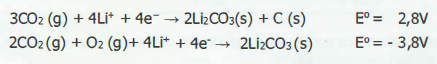
Sobre essas baterias, é correto afirmar que
Em relação aos processos de obtenção de metais a partir de minerais, e com base nos conhecimentos sobre reações de oxidorredução, considere as afirmativas a seguir.
I. Alo (s) pode ser obtido a partir de bauxita (Al2O3.H2O ) por meio de um método eletrolítico, o qual é baseado num processo não espontâneo onde Al3+ é reduzido a Alo (s). II. Cuo (s) pode ser obtido a partir da queima de sulfeto de cobre, conforme reação Cu2S(s) + O2(g) → 2Cu(s) + SO2(g), onde o número de oxidação do cobre muda de (1+) para (0). III. Feo (s) pode ser obtido a partir de reações de redução de óxidos de ferro conforme transformações químicas: Fe2O3(s) → FeO2(s) → Feo (s). IV. Mno (s) pode ser obtido a partir da reação MnO2(s)+ C(s) → Mn(s) + CO2(g) em que o átomo de oxigênio em MnO2(s) é o redutor e o carbono (C) é o oxidante.
Assinale a alternativa correta.
A água oxigenada é utilizada como agente antisséptico devido à produção de gás oxigênio na sua decomposição, que ocorre conforme a equação
2H2O2(l) → 2H2O(l) + O2(g)
Essa equação indica que a espécie ganhadora de elétrons é

