Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 418 questões
 , X e Y devem ter, respectivamente, propriedade
, X e Y devem ter, respectivamente, propriedade 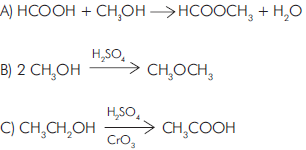
Na reação representada pela equação: após o balanceamento, o coeficiente do agente oxidante
será
após o balanceamento, o coeficiente do agente oxidante
será
I. 2H2S(g) + H2SO3(aq) ➡︎ 3S(s) + 3H2O(l) II. H2S(g) + 2H+(aq) + SO42-(aq) ➡︎ SO2(g) + S(s) + 2H2O(l) III. H2S(g) + Pb(s) ➡︎ PbS(s) + H2(g) IV. 2H2S(g) + 4Ag(s) + O2(g) ➡︎ 2Ag2S(s) + 2H2O(l)
Nas reações representadas pelas equações acima, o sulfeto de hidrogênio é agente redutor em:
I. 2H2S(g) + H2SO3(aq) ↠ 3S(s) + 3H2O(l) II. H2S(g) + 2H+(aq) + SO4 2-(aq) ↠ SO2(g) + S(s) + 2H2O(l) III. H2S(g) + Pb(s) ↠ PbS(s) + H2(g) IV. 2H2S(g) + 4Ag(s) + O2(g) ↠ 2Ag‚S(s) + 2H2O(l)
Nas reações representadas pelas equações acima, o sulfeto de hidrogênio é agente redutor em:
HgO(s) + Zn(s) + H2O(l) ↠ Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
HgO(s) + Zn(s) + H2O(l) → Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
Cu2+(aq) + 2 e- → Cu (s)
A quantidade de elétrons, em mols, necessária para a obtenção de 254g de cobre puro é
Al+ 3 + 3e → Al (-1,66 V) Fe+2 + 2e → Fe (-0,44 V),
a ddp da pilha Al ; Al+3 ; Fe+2 ; Fe, em condições - padrão, é:
Com relação à pilha Fe0 /Fe2+║Cu2+/Cu0 , assinale o que for correto.
Dados:
Fe2+ + 2e- → Fe0 E0
= - 0,44 V
Cu2+ + 2e- → Cu0 E0 = + 0,34 V
Com relação à pilha Fe0 /Fe2+║Cu2+/Cu0 , assinale o que for correto.
Dados:
Fe2+ + 2e- → Fe0 E0
= - 0,44 V
Cu2+ + 2e- → Cu0 E0 = + 0,34 V
Com relação à pilha Fe0 /Fe2+║Cu2+/Cu0 , assinale o que for correto.
Dados:
Fe2+ + 2e- → Fe0 E0
= - 0,44 V
Cu2+ + 2e- → Cu0 E0 = + 0,34 V
Com relação à pilha Fe0 /Fe2+║Cu2+/Cu0 , assinale o que for correto.
Dados:
Fe2+ + 2e- → Fe0 E0
= - 0,44 V
Cu2+ + 2e- → Cu0 E0 = + 0,34 V
Com relação à pilha Fe0 /Fe2+║Cu2+/Cu0 , assinale o que for correto.
Dados:
Fe2+ + 2e- → Fe0 E0
= - 0,44 V
Cu2+ + 2e- → Cu0 E0 = + 0,34 V
( ) O potencial padrão de redução do alumínio (E° = −1,66V) mostra que ele é facilmente oxidado. ( ) A resistência do alumínio à corrosão deve-se à formação de uma camada fina, dura e transparente de Al2O3 que adere à superfície do metal. ( ) A quantidade de matéria de alumínio necessária para se obter 204g de Al2O3 é 2,5 mols. ( ) O átomo de alumínio possui número atômico 13 e massa 26,98u.
Assinale a seqüência correta.
2 MnO2(s) + H2O(l) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq) Zn(s) + 2 OH⁻(aq) → Zn(OH)2(s) + 2e⁻
Sobre essa pilha, é incorreto afirmar que:
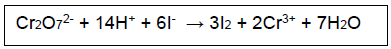
Com base na reação, é CORRETO afirmar: