Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões
Adaptado de: http://noticias.uol.com.br/ciencia/ultimas-noticias/bbc/2016/06/12/ (Acesso em: 20/06/2016)
A seguir, são feitas algumas afirmações sobre possíveis vantagens do sistema.
I. O gás nitrogênio produzido nessa eletrólise é um combustível menos poluente que o hidrogênio.
II. A ureia é decomposta em amônia que é vaporizada no sistema, antes de seguir para alimentar uma célula onde o gás é utilizado como combustível.
III. A energia fornecida para a produção do combustível pode ser menor que a utilizada na eletrólise da água, pois as ligações entre os átomos de hidrogênio e nitrogênio são mais fracas que as ligações entre os átomos da água.
Está CORRETO o que se afirma, apenas, em
HgO(s) + Zn(s) + H2O(l) ↠ Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
HgO(s) + Zn(s) + H2O(l) → Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
Cu2+(aq) + 2 e- → Cu (s)
A quantidade de elétrons, em mols, necessária para a obtenção de 254g de cobre puro é
CH3CH2OH + OH· → H2O + CH3CHOH·
Sobre esta reação, podemos afirmar o que segue.
8 Cl2(g) + 8 H2S(aq) → S8(s) + 16 HCl(aq)
Analisando a reação redox acima, três afirmações foram feitas:
1) O H2S é o agente oxidante.
2) O NOX (número de oxidação) do cloro varia de zero para -1; portanto, o cloro sofre redução.
3) Cada mol de Cl2 gasoso recebe 2 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):
DADOS QUE PODEM SER USADOS NESTA PROVA:

DADOS QUE PODEM SER USADOS NESTA PROVA:

No laboratório de Química foi realizada uma experiência, cujo procedimento foi o seguinte:
1. Em dois tubos de ensaio, colocou-se 5 mL de água destilada em cada um.
2. Em seguida, acrescentou-se 3 gotas de lugol (solução de iodo em iodeto de potássio 1%) em cada um dos tubos de ensaio. Por causa do iodo, a solução ficou de cor marrom amarelada.
3. Pulverizou-se um comprimido de vitamina C (C6H8O6), usando-se um almofariz com pistilo, e adicionou-se em um dos tubos de ensaio.
4. Agitou-se o tubo de ensaio que continha o comprimido de vitamina C pulverizado e observou-se a descoloração da solução.
Com relação a essa experiência, assinale a afirmação correta.
Em museus, igrejas ou locais com materiais de decoração é comum ver objetos de prata com manchas escuras, formadas devido à reação química que ocorre com a prata e o enxofre presente no ar ou mesmo na pele do corpo. Para remover essas manchas, recorre-se a um procedimento de limpeza eletroquímica em que se mergulha o objeto de prata em um frasco de alumínio contendo solução aquosa de bicarbonato de sódio aquecida. O alumínio reage com o sulfeto, regenerando a prata com seu característico brilho metálico.
Observe as semirreações de redução para a prata e o alumínio juntamente com os seus potenciais padrão de redução:
Ag+(aq) + e- -> Ag°(s) ε° = +0,80 V
Al3+ (aq) + 3 e- -> Al°(s) ε° = - 1,66 V
Na pilha formada por essas semi-reações,


Com o passar do tempo, e o seu uso, jóias de prata perdem seu aspecto brilhante, tornando-se escuros. Isso ocorre porque os átomos de prata da superfície do objeto reagem com compostos de enxofre presentes no suor, formando uma película escura de sulfeto de prata. Esta película pode ser removida colocando-se o objeto escurecido em uma panela de alumínio contendo bicarbonato de sódio. O alumínio reage com a prata presente na película, transformando-se no cátion alumínio. Esse processo é acelerado em água quente. As semi reações deste processo são dadas por:
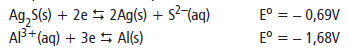
Considerando a reação de oxi-redução, assinale a alternativa correta.
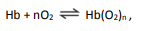
em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal.
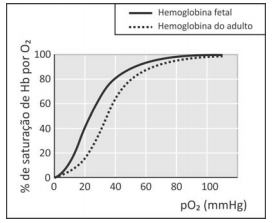
A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
A porcentagem de saturação pode ser entendida como :
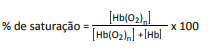
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
É correto apenas o que o estudante afirmou em
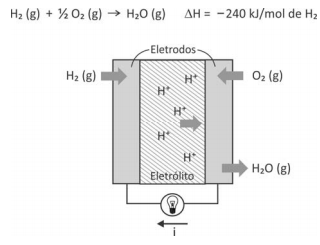
A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo , é
I. Se tivesse ocorrido apenas combustão incompleta, restaria propano no reator. II. Para que todo o propano reagisse, considerando a combustão completa, seriam necessários, no mínimo, 750 L de ar. III. É provável que, nessa combustão, tenha se formado fuligem.
Está correto apenas o que se afirma
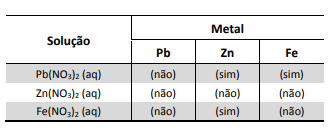
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
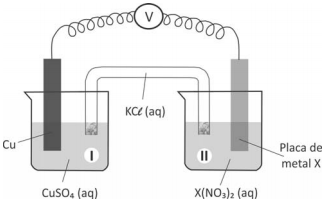
Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq). Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V. A atribuição correta desses valores de força eletromotriz a cada uma das pilhas, de acordo com a reatividade dos metais testados, deve se
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
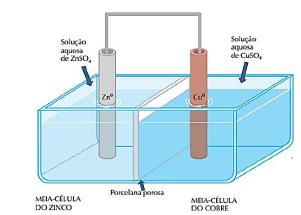
(Fonte: Adaptado de Feltre, R. Química. v.2, 6 ed. São Paulo: Moderna, 2004.)
Sabendo que o potencial padrão de redução a 25°C, em relação ao eletrodo padrão de hidrogênio, é de +0,34 V para a semirreação Cu2+ (aq) + 2 e- → Cu(s), e de -0,76 V para a semirreação Zn2+ + 2e- → Zn (s), assinale a alternativa incorreta.

(Disponível em:<http://tirinhasdefisica.blogspot.com.br/>
As lâmpadas incandescentes, como as presentes na charge, foram progressivamente substituídas por outros tipos de menor consumo de energia elétrica.
Com base nos conhecimentos sobre reações de oxidação e redução e considerando que a rosca dessa lâmpada seja confeccionada em ferro (Fe(s)) e que esteja sendo utilizada em um ambiente úmido, assinale a alternativa correta.
(Valores dos potenciais padrão de redução: Cu2+/Cu(s) = +0,34 V;
Zn2+/Zn(s) = -0,76 V; Sn2+/Sn(s) = -0,14 V; Fe2+/Fe = -0,44 V;
Ag+/Ag(s) = +0,80 V; Mg2+/Mg(s) = -2,38 V)
