Questões de Vestibular de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 420 questões

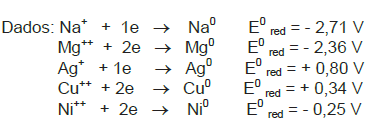
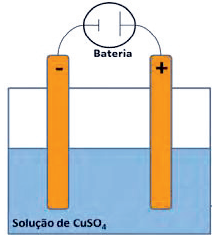
Qual é o sal presente na solução adicionada ao béquer?
Sobre esse processo, são feitas as afirmações a seguir:
I. No catodo (–), que é o cobre puro, ocorre depósito de mais cobre em virtude da redução do Cu2+ .
II. A corrosão faz a solução aumentar a concentração de Cu2+, que é atraído para o catodo, formando cobre metálico livre das impurezas.
III. Uma solução aquosa de NiSO4 aumentaria a deposição de cobre puro no catodo.
IV. No anodo (+), existe a oxidação do cobre metálico.
 Adaptado de:
http://www.acervodigital.unesp.br/bitstream/
123456789/46363/4/2ed_qui_m4d7.pdf
Adaptado de:
http://www.acervodigital.unesp.br/bitstream/
123456789/46363/4/2ed_qui_m4d7.pdf Está CORRETO, apenas, o que se afirma em
Adaptado de: http://noticias.uol.com.br/ciencia/ultimas-noticias/bbc/2016/06/12/ (Acesso em: 20/06/2016)
A seguir, são feitas algumas afirmações sobre possíveis vantagens do sistema.
I. O gás nitrogênio produzido nessa eletrólise é um combustível menos poluente que o hidrogênio.
II. A ureia é decomposta em amônia que é vaporizada no sistema, antes de seguir para alimentar uma célula onde o gás é utilizado como combustível.
III. A energia fornecida para a produção do combustível pode ser menor que a utilizada na eletrólise da água, pois as ligações entre os átomos de hidrogênio e nitrogênio são mais fracas que as ligações entre os átomos da água.
Está CORRETO o que se afirma, apenas, em
Um dos tipos de pilha mais eficientes são as de lítio. A reação redox que ocorre nessas pilhas é, simplificadamente, representada a seguir:
2 Li (s) + I2 (s) → 2 Li+ (aq) + 2 I−(aq)
Dados:
Eo Li+/Li = −3,05 V
Eo I2 /I− = +0,53 V