Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões


Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.

A infraestrutura precária de alguns locais que sediam
eventos com grande público, como jogos de futebol e shows
musicais, e a falta de educação de pessoas que insistem em urinar
em locais completamente inapropriados, como paredes e viadutos,
têm causado sérios problemas. Além do mau cheiro, o ácido úrico,
presente na urina, penetra pelos poros do concreto e causa corrosão
de estruturas metálicas.
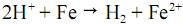 , a reação de oxidação do ferro em meio ácido, tem, a 25 º C, potencial elétrico padrão, igual a 0,44 V.
, a reação de oxidação do ferro em meio ácido, tem, a 25 º C, potencial elétrico padrão, igual a 0,44 V. I. As reações envolvidas nesse processo são de óxido-redução.
II. O escurecimento do objeto de prata se deve a prata na sua forma oxidada.
III. A prata volta a brilhar porque sofre uma reação de oxidação e volta para a sua forma metálica (Ag).
IV. A prata volta a brilhar porque sofre uma reação de redução e volta para a sua forma metálica (Ag).
V. O alumínio é extremamente necessário, pois participa da reação que envolve transferência de elétrons.
verifica-se que estão corretos apenas
KMnO4 (aq) +HF (aq) → KF (aq) + MnF2 (aq) + H2O (l) + F2 (g)
Balanceie a equação química e, baseando-se na equação balanceada, assinale a proposição correta acerca dos estados de oxidação das espécies químicas e da estequiometria da reação:
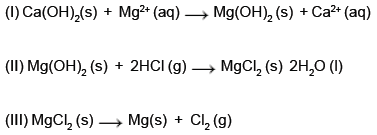
A partir das reações representadas e das propriedades dos elementos e substâncias, é correto afirmar:
 Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V 

DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Com relação ao ferro, assinale a opção correta.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Ag(s) + H2S(g) + O2(g) → Ag2S(s) + H2O(l)
Considerando esse processo, assinale a opção correta.