Questões de Vestibular de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 420 questões
A transferência do alumínio da panela para o alimento envolve a:
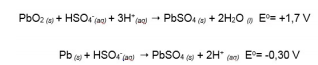
Analise as alternativas abaixo selecionadas com as semi-reações (1) e (2). I. Na Equação 1, é onde ocorre a reação de oxidação, e na Equação 2 a reação de redução. II. A Equação 1 pode ser identificada como anodo e a Equação 2 o catodo. III. No processo eletroquímico, estão envolvidos 2 mols de elétrons. IV. O chumbo é agente redutor e, também, agente oxidante. V. A célula voltaica gera 2 Volts.
Está incorreto o que se afirma em

A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio.

Sobre tais reações, pode-se dizer que: