Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 419 questões
Considerando que 96.500 C é a quantidade de carga transportada por 1mol de elétrons, é CORRETO afirmar que a fórmula do composto de brometo é
Dados: Massas molares (g/mol) H = 1,00 O = 16,0 Cu = 63,5
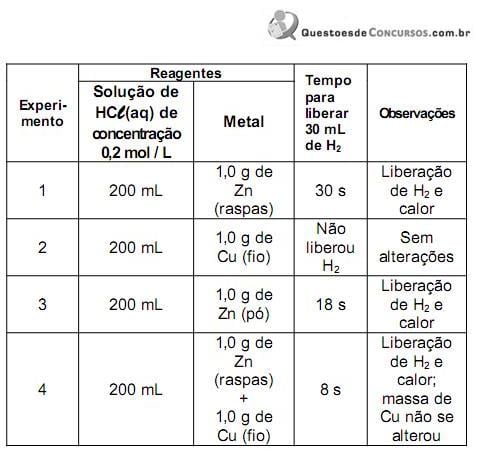
Após realizar esses experimentos, a estudante fez três afirmações:
I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.
II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2.
III. Os resultados dos experimentos 1 e 3 mostram que, quanto maior o quociente superfície de contato/massa total de amostra de Zn, maior a velocidade de reação.
Com os dados contidos na tabela, a estudante somente poderia concluir o que se afirma em
Na0 + H2O
 NaOH + 1/2 H2
NaOH + 1/2 H2Assinale a alternativa que apresenta a classe de reação na qual se enquadra essa transformação.




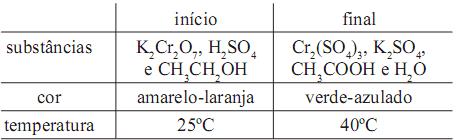
A soma dos índices estequiométricos da equação da reação devidamente balanceada e a classificação desta reação quanto ao calor envolvido são, respectivamente,
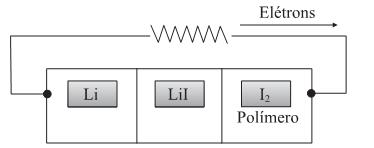
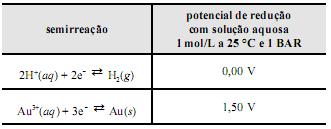
Para esta pilha, são dadas as semi-reações de redução:

São feitas as seguintes afirmações sobre esta pilha:
I. No ânodo ocorre a redução do íon Li + .
II. A ddp da pilha é + 2,51 V.
III. O cátodo é o polímero/iodo.
IV. O agente oxidante é o
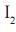 .
.São corretas as afirmações contidas apenas em
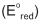
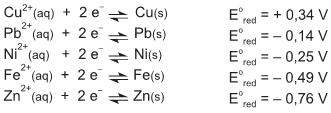
Em um estudo eletroquímico foram montadas 4 pilhas a partir de 4 pares redox distintos. Em todos os dispositivos o cátodo era constituído de uma solução aquosa de íons
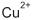 de concentração 1,0 mol/L e um eletrodo de cobre metálico. O ânodo era constituído de um metal ( M ), diferente em cada dispositivo,
de concentração 1,0 mol/L e um eletrodo de cobre metálico. O ânodo era constituído de um metal ( M ), diferente em cada dispositivo,imerso em solução do respectivo cátion
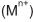 também de concentração 1,0mol/L.
também de concentração 1,0mol/L.A figura a seguir representa esquematicamente o aparato experimental.
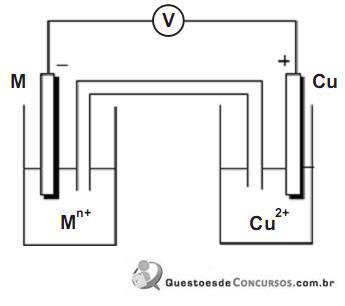
Os metais utilizados como ânodo foram zinco, níquel, chumbo e ferro. Em cada experimento foram determinadas a ddp inicial da pilha e a quantidade de carga gerada pela pilha durante a corrosão de 1,00 g do ânodo. Nestas condições, pode- se dizer que o ânodo cuja pilha apresenta a maior ddp e o ânodo cuja pilha gera a maior quantidade de carga são formados, respectivamente, pelos metais
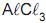 , a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a:
, a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a: e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.
e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce. Sobre o cobre e seus óxidos, é CORRETO afirmar que:

Considerando essas informações, julgue os próximos itens.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.

