Dados: potenciais padrão de redução ...
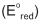
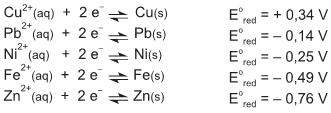
Em um estudo eletroquímico foram montadas 4 pilhas a partir de 4 pares redox distintos. Em todos os dispositivos o cátodo era constituído de uma solução aquosa de íons
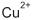 de concentração 1,0 mol/L e um eletrodo de cobre metálico. O ânodo era constituído de um metal ( M ), diferente em cada dispositivo,
de concentração 1,0 mol/L e um eletrodo de cobre metálico. O ânodo era constituído de um metal ( M ), diferente em cada dispositivo,imerso em solução do respectivo cátion
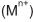 também de concentração 1,0mol/L.
também de concentração 1,0mol/L.A figura a seguir representa esquematicamente o aparato experimental.
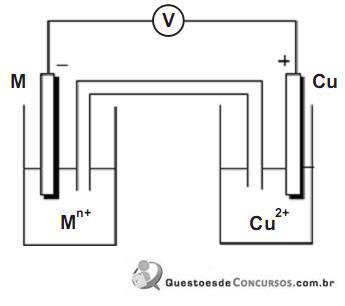
Os metais utilizados como ânodo foram zinco, níquel, chumbo e ferro. Em cada experimento foram determinadas a ddp inicial da pilha e a quantidade de carga gerada pela pilha durante a corrosão de 1,00 g do ânodo. Nestas condições, pode- se dizer que o ânodo cuja pilha apresenta a maior ddp e o ânodo cuja pilha gera a maior quantidade de carga são formados, respectivamente, pelos metais
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
A ddp (Δε) de uma pilha pode ser calculada como: ΔE = Ered maior – Ered menor
Como o metal que possui maior Ered é o Cu, podemos escrever:
ΔE = EredCu – EredM = 0,34 V – EredM
Logo,
para se obter maior ΔE, o potencial de redução do metal M deve ser o menor
possível.
Portanto,
para obter a pilha com maior ΔE, devemos usar o Zn como ânodo.
Agora, para descobrir a pilha que gera a maior quantidade de carga, vamos considerar a equação genérica de oxidação de M:
M(s) → M2+ + 2e–
Cada
mol do metal M gera uma carga de 2 ⋅ 96500 C, equivalente a 2 mol de
elétrons. Assim, quanto maior o número de
mol do metal que oxida, maior a carga gerada.
Podemos calcular a quantidade de mol por meio da seguinte relação:
n = m/M = 1 g/M
Concluímos,
então, que quanto menor a massa molar do metal, maior o número de mol.
Consultando a tabela periódica, obtemos as massas molares:
Fe = 55,8
Ni = 58,7
Zn = 65,4
Pb
= 207
Logo,
a pilha que gera a maior quantidade de carga usa Fe como ânodo.
Opção correta E.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo