A bateria primária de lítio-iodo surgiu em 1967, nos Estados...
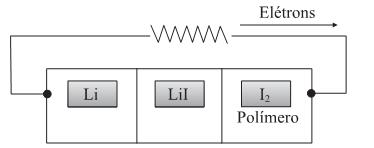
Para esta pilha, são dadas as semi-reações de redução:

São feitas as seguintes afirmações sobre esta pilha:
I. No ânodo ocorre a redução do íon Li + .
II. A ddp da pilha é + 2,51 V.
III. O cátodo é o polímero/iodo.
IV. O agente oxidante é o
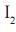 .
.São corretas as afirmações contidas apenas em
- Gabarito Comentado (1)
- Aulas (10)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
2Li --> 2Li⁺ + 2e⁻
I₂ + 2e⁻ --> 2I⁻
________________
2Li + I₂ --> 2Li⁻ + 2I⁻
2Li: Perdeu elétrons, logo, oxidou (agente redutor)
I₂: Ganhou elétrons, logo, reduziu (agente oxidante)
I: Segundo nossa equação, é fácil perceber que quem oxidou foi o Lítio.
II: Para calcular a DDP você SEMPRE inverte o sinal do menor potencial de redução e soma com o outro valor, então: -(-3,05) + 0,54 = 3,59 ddp
III: O cátodo é o Iodo (na pilha é sempre quem reduz).
IV: O agente oxidante é mesmo o Iodo, pois ele contribuiu para a oxidação do Lítio.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo