Considerando 1 F = 96.500 C (quantidade de eletricidade rela...
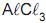 , a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a:
, a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a:Comentários
Veja os comentários dos nossos alunos
gab C
aluminio vai ganhar 3 eletrons da reducao
entao 1 mol eletrons ta pra 96.500 C x 3 ta pra 27g(massa molar )
assim cm x mol ta pra x carga ta pra 21,6 g
96500x3x21,6=27X
X=231600C
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo