Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 419 questões
Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:

A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.

Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq). Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V.
A atribuição correta desses valores de força eletromotriz a
cada uma das pilhas, de acordo com a reatividade dos metais
testados, deve ser
Considere as seguintes semicélulas e os respectivos potenciais-padrão de redução, numerados de I a VI.
I) Mn2+ (aq)/Mn(s) E0 =-1,18 V
II) Al3+ (aq)/Al(s) E0 =-1,66 V
III) Ni2+ (aq)/Ni(s) E0 =-0,25 V
IV) Pb2+ (aq)/Pb(s) E0 =-0,13 V
V) Ag+ (aq)/Ag(s) E0 = +0,80 V
VI) Cu2+ (aq)/Cu(s) E0 = +0,34 V
As duas semicélulas que formariam uma pilha com maior diferença de potencial são
Em linhas gerais, o consumo de água aumentou de forma considerável em todo o planeta ao longo do tempo. Em 1900, o mundo consumia cerca de 580 km³ de água; já em 1950, esse consumo elevou-se para 1400 km³, passando para 4000 km³ em 2000. Segundo previsões da ONU, é provável que em 2025 o nível de consumo eleve-se para 5200 km³. A despeito dessa elevação da utilização da água, registra-se também o aumento do número de pessoas sem fácil acesso à água potável, totalizando 1,1 bilhão em todo o planeta a sofrer com esse problema.
Além da utilização exagerada na área doméstica e no plano individual, soma-se o intensivo consumo de água nas atividades econômicas, notadamente a agricultura e a indústria, isso sem contar o grande volume desperdiçado. Não por acaso, a maior parte do consumo mundial de água acontece nos países desenvolvidos. Os emergentes ou subdesenvolvidos consomem em menor quantidade em razão do menor acesso à água e da menor intensidade das práticas econômicas. Segundo a ONU, o consumo dos países centrais é seis vezes maior do que o consumo dos países periféricos.
Fonte: http://brasilescola.uol.com.br/geografia/consumo-agua-no-mundo.htm
A pilha seca tem potencial padrão de 1,5 V e consiste de um anodo de zinco e um catodo de dióxido de manganês. O meio eletrolítico é uma pasta umedecida contendo carvão, cloreto de amônio e cloreto de zinco. A equação química da reação espontânea que ocorre da pilha é a seguinte:
Zn(s) + 2 MnO2(aq) + 2 NH4 + (aq) → Zn2+(aq) + Mn2 O3(s) + 2 NH3(g) + H2 O(aq)
A variação no valor de Nox na semirreação de redução é de
Em seu artigo “Mecanismos Redox de Compostos Aromáticos, Aminoácidos e Proteínas, em Eléctrodos de Carbono”, Teodor Adrian Enache, pesquisador da Faculdade de Ciências e Tecnologia, da Universidade de Coimbra, Portugal, discute a reação entre oxidação e aminoácidos.
Assinale a afirmação verdadeira a respeito dessa
reação.
Nesse processo, o oxigênio sofre a transformação química denominada:
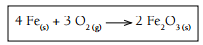
No interior do casco dos navios, existem tanques que podem ter seu volume preenchido parcial ou totalmente com água do mar em função das necessidades de flutuabilidade.
Como os tanques são constituídos de materiais metálicos, eles sofrem, ao longo do tempo, corrosão pelo contato com a água do mar, conforme a equação:
4 Fe (s) + 3 O2 (g) 2 Fe2 O3 (s)
Um processo corrosivo no interior de um tanque fechado apresenta as seguintes características:

Admita que, durante todo o processo de corrosão, o ar no interior do tanque esteve submetido
às CNTP, com comportamento ideal, e que apenas o oxigênio presente no ar foi consumido.
Considere o processo de dissolução de sulfato ferroso em água, no qual ocorre a dissociação desse sal.
Após esse processo, ao se aplicar um campo elétrico, o seguinte íon salino irá migrar no sentido do polo positivo:

Nas últimas décadas, o dióxido de enxofre (SO2 ) tem sido o principal contaminante atmosférico que afeta a distribuição de liquens em áreas urbanas e industriais. Os liquens absorvem o dióxido de enxofre e, havendo repetidas exposições a esse poluente, eles acumulam altos níveis de sulfatos (SO42– ) e bissulfatos (HSO4– ), o que incapacita os constituintes dos liquens de realizarem funções vitais, como fotossíntese, respiração e, em alguns casos, fixação de nitrogênio.
(Rubén Lijteroff et al. Revista Internacional de contaminación ambiental, maio de 2009. Adaptado.)
Nessa transformação do dióxido de enxofre em sulfatos e bissulfatos, o número de oxidação do elemento enxofre varia de _______ para ______ , portanto, sofre __________.
As lacunas desse texto são, correta e respectivamente, preenchidas
por:
O funcionamento da pilha comumente utilizada em controles remotos de TV, também conhecida como pilha seca ou de Leclanché, é expresso pela equação química a seguir:
Zn(s) + 2 MnO2(s) + 2 NH4 +(aq) → Zn2+(aq) + Mn2 O3(s) + 2 NH3(g) + H2O(l)
Um dos motivos de essa pilha não ser recarregável é
porque
INSTRUÇÃO: Para responder à questão, analise
as informações a seguir.
O fogo sempre foi objeto de fascínio e instrumento de extrema utilidade para o ser humano. Mesmo hoje, com o uso cada vez mais disseminado da energia elétrica, não deixamos de utilizar o fogo no cotidiano: ainda queimamos carvão na churrasqueira, lenha na lareira, gás liquefeito de petróleo no fogão e parafina nas velas.
Sobre esse assunto, são apresentadas as seguintes afirmativas:
I. A combustão é uma reação redox em que o comburente age como oxidante.
II. Na combustão do gás de cozinha, há produção de água, mas na do carbono não há.
III. A velocidade de combustão do carvão em pedaços é igual à do carvão em pó.
IV. As reações de combustão são exotérmicas e liberam gás carbônico.
Em relação à combustão, são corretas somente as
afirmativas
O ânion bromato reage com o ânion brometo em meio ácido gerando a substância simples bromo segundo a equação:
BrO3-(aq) + 5 Br-(aq) + 6 H+ (aq) → 3 Br2(aq) + 3 H2O(l)
A cinética dessa reação foi estudada a partir do acompanhamento dessa reação a partir de diferentes concentrações iniciais das espécies
BrO3- (aq), Br- (aq) e H+(aq).
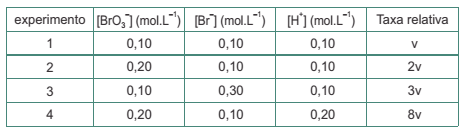
Ao analisar esse processo foram feitas as seguintes observações:
I. Trata-se de uma reação de oxidorredução.
II. O ânion brometo (Br- ) é o agente oxidante do processo.
III. A lei cinética dessa reação é v = k[BrO3 ][Br ][H+ ]2 .
Pode-se afirmar que estão corretas
Fotossíntese artificial gera hidrogênio para células a combustível
Redação do Site Inovação Tecnológica - 18/02/2010
Fontes de energia do futuro
Células a combustível alimentadas por hidrogênio e por energia solar são as duas maiores esperanças para as fontes de energia do futuro, por serem mais amigáveis ambientalmente e, sobretudo, sustentáveis.
A combinação das duas, então, é considerada como particularmente limpa: produzir hidrogênio para alimentar as células a combustível, quebrando moléculas de água com a luz solar, seria de fato o melhor dos mundos.
Esta é a chamada fotossíntese artificial, que vem sendo alvo de pesquisas de vários grupos de cientistas, ao redor do mundo.
Eletrodo fotocatalítico
Uma equipe liderada por Thomas Nann e Christopher Pickett, da Universidade de East Anglia, no Reino Unido, criou um fotoeletrodo eficiente, robusto, que pode ser fabricado com materiais comuns e de baixo custo.
O novo sistema consiste de um eletrodo de ouro que é recoberto com camadas formadas por nanopartículas de fosfeto de índio (InP). A esse eletrodo, os pesquisadores adicionaram um composto de ferro-enxofre [Fe2 S2 (CO)6 ] sobre as camadas.
Quando submerso em água e iluminado com a luz do Sol, sob uma corrente elétrica relativamente fraca, este sistema fotoeletrocatalítico produz hidrogênio com uma eficiência de 60%.
(
Considerando as substâncias químicas empregadas na construção do eletrodo fotocatalítico, o qual permite a realização da fotossíntese artificial, pode-se notar que há uma substância simples, formada por átomos de um único elemento químico, e substâncias compostas, formadas por átomos de mais de um elemento químico.
A única substância simples empregada nesse eletrodo é
Em relação à eletrólise,
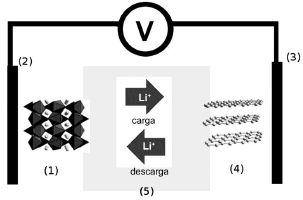
Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente:

Em um experimento em laboratório de química, montou-se uma célula eletrolítica de acordo com o esquema:
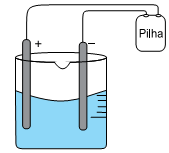
Usaram-se como eletrodo dois bastões de grafite, uma solução aquosa 1,0 mol.L–1 de CuSO4 em meio ácido a 20 °C e uma pilha.
Alguns minutos, após iniciado o experimento, observaram-se a formação de um sólido de coloração amarronzada sobre a superfície do eletrodo de polo negativo e a formação de bolhas na superfície do eletrodo de polo positivo.
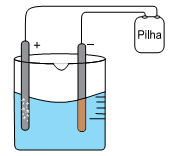
Com base nos potenciais de redução a 20 °C,
Cu2+ (aq) +2e– → Cu (s) + 0,34 V
2H+ (aq) + 2e– → H2 (g) 0,00 V
O2 (g) + 4H+ (aq) + 4e– → H2O (l) + 1,23 V
É correto afirmar que se forma cobre no