Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões
TEXTO 7
Memórias de um pesquisador
Não era bem vida, era uma modorra – mas de qualquer modo suportável e até agradável. Terminou bruscamente, porém, eu estando com vinte e oito anos e um pequeno bujão de gás explodindo mesmo à minha frente, no laboratório de eletrônica em que trabalhava, como auxiliar. Me levaram às pressas para o hospital, os médicos duvidando que eu escapasse. Escapei, mas não sem danos. Perdi todos os dedos da mão esquerda e três (sobraram o polegar e o mínimo) da direita. Além disso fiquei com o rosto seriamente queimado. Eu já não era bonito antes, mas o resultado final – mesmo depois das operações plásticas – não era agradável de se olhar. Deus, não era nada agradável.
No entanto, nos primeiros meses após o acidente eu não via motivos para estar triste. Aposentei-me com um bom salário. Minha velha tia, com quem eu morava, desvelava-se em cuidados. Preparava os pastéis de que eu mais gostava, cortava-os em pedacinhos que introduzia em minha boca – derramando sentidas lágrimas cuja razão, francamente, eu não percebia. Deves chorar por meu pai – eu dizia – que está morto, por minha mãe que está morta, por meu irmão mais velho que está morto; mas choras por mim. Por quê? Escapei com vida de uma explosão que teria liquidado qualquer um; não preciso mais trabalhar; cuidas de mim com desvelo; de que devo me queixar?
Cedo descobri. Ao visitar certa modista.
Esta senhora, uma viúva recatada mas ardente, me recebia todos os sábados, dia em que os filhos estavam fora. Quando me senti suficientemente forte telefonei explicando minha prolongada ausência e marcamos um encontro.
Ao me ver ficou, como era de se esperar, consternada. Vais te acostumar, eu disse, e propus irmos para a cama. Me amava, e concordou. Logo me deparei com uma dificuldade: o coto (assim eu chamava o que tinha me sobrado da mão esquerda) e a pinça (os dois dedos restantes da direita) não me forneciam o necessário apoio. O coto, particularmente, tinha uma certa tendência a resvalar pelo corpo coberto de suor da pobre mulher. Seus olhos se arregalavam; quanto mais apavorada ficava, mais suava e mais o coto escorregava.
Sou engenhoso. Trabalhando com técnicos e cientistas aprendi muita coisa, de modo que logo resolvi o problema: com uma tesoura, fiz duas incisões no colchão. Ali ancorei coto e pinça. Pude assim amá-la, e bem.
– Não aguentava mais – confessei, depois. – Seis meses no seco!
Não me respondeu. Chorava. – Vais me perdoar, Armando – disse – eu gosto de ti, eu te amo, mas não suporto te ver assim. Peço-te, amor, que não me procures mais.
– E quem vai me atender daqui por diante? – perguntei, ultrajado.
Mas ela já estava chorando de novo. Levantei-me e saí. Não foi nessa ocasião, contudo, que fiquei deprimido. Foi mais tarde; exatamente uma semana depois.
[...]
(SCLIAR, Moacyr. Melhores contos. Seleção de
Regina Zilbermann. São Paulo: Global, 2003. p.
176-177.)
A pólvora, usada como explosivo desde tempos remotos, é uma mistura de nitrato de potássio, enxofre e carvão. Com a explosão, ocorre formação de sulfato de potássio, dióxido de carbono e nitrogênio molecular.
Sobre essa explicação acerca da explosão, assinale a única afirmação correta:

TODO PIONEIRO É UM FORTE, pensava Bambico. Acredita nos sonhos. Se não fosse por ele, o mundo ainda estaria no tempo das cavernas... Quanto mais pensava nisso, mais se fortalecia.
Bambico chegara à Amazônia com as mãos vazias, vindo do Sul. Mas tinha na cabeça projetos grandiosos. Queria extrair da natureza toda a riqueza intacta, como o garimpeiro faz. Não desejava, entretanto, cavar rio e terra para achar pepitas de ouro. Não tinha vocação para tatu. Não faria como os garimpeiros: quando não havia mais nada, eles se mudavam, atrás de outros garimpos.
— Garimpeiro vive de ilusões. Eu gosto de projetos!
Que projetos grandiosos eram? Cortar árvores, exportar madeiras preciosas para a casa e a mobília dos ricos. Em seguida, semear capim, povoando os campos com as boiadas de nelore brilhando de tanta saúde. A riqueza estava acima do chão. A imensidão verde desaparecia no horizonte. Só de olhar para uma árvore, sabia quantos dólares cairia em seus bolsos. Quando ouvia os roncos das motosserras, costumava dizer, orgulhoso:
— Eis o barulho da fortuna!
Montes de serragem eram avistados de longe quando o visitante chegava às pequenas comunidades. Os caminhões de toras gemiam nas estradas esburacadas. Índios e caboclos eram afugentados à bala. A floresta se transformava num pó fino, que logo apodrecia. Quando os montes de serragem não apodreciam, eram queimados, sempre apressadamente. Por dias, os canudos negros de fumaça subindo pesadamente ao céu. Havia o medo dos fiscais. Quando apareciam, quase nunca eram vistos, era conveniente que houvesse pouca serragem...
Que história, a de Bambico! Teria muita coisa a contar para os netos que haveriam de chegar.
Em seu escritório, fumando um Havana, que um importador americano lhe presenteara, estufou o peito, vaidoso.
— Sim, muitas coisas! Quem te viu, quem te vê!
[...]
Sentia prazer com seus projetos grandiosos. Toda manhã se levantava para conquistar o mundo. Vereança era merreca. Não se rastejava em pequenos projetos. Muito menos desejava ser deputado... Ambicionava altos voos. Todo deputado era pau-mandado dos ricos. O Senado, sim, era o grande alvo. Lá, ele poderia afrontar esses “falsos profetas protetores da natureza". Essas ONGs de fachada... Lá, o seu cajado cairia sem dó, como um verdugo, sobre o costado dessa gente tola. Enquanto isso, ele poderia continuar seus projetos grandiosos. Cortar árvores, exportar madeiras preciosas para a casa e a mobília dos ricos, e semear capim.
Sonhara em ter uma dúzia de filhos, mas o destino lhe dera apenas dois. Sua mulher, após o segundo parto, ficara impossibilitada de procriar. Não queria fêmea entre os seus descendentes, mas logo no primeiro parto veio a decepção. Uma menina. Decepcionado, nada comentou com a esposa. No segundo, depois de uma gravidez tumultuada, veio o varão. Encheu-se de alegria. Com certeza, mais varões estavam para vir... [...]
(GONÇALVES, David. Sangue verde. São Paulo: Sucesso Pocket, 2014. p. 114-115.)
“ Não desejava, entretanto, cavar rio e terra para achar pepitas de ouro."
O cianeto de sódio (NaCN) é muito utilizado na extração do ouro. Ele facilita a oxidação do ouro e a sua solubilização. Para evitar a liberação de ácido cianídrico (HCN), que é um gás muito tóxico, essa etapa do processo é feita em meio alcalino.
Uma provável reação para essa etapa é descrita a seguir:
4Au + 8NaCN + O2 + 2H2 O → 4NaAu(CN)2 + 4NaOH
Em seguida, a recuperação do ouro (redução) é feita por precipitação através da adição de zinco em pó.
Assinale a única alternativa correta com relação às afirmações anteriormente expostas:
H2SO4 (conc) + NaCl(s) → HCl(g) + NaHSO4 (s)
4 HCl(aq) + MnO2 (s) → MnCl2 (aq) + 2 H2 O(l) + Cl2 (g)
Sobre essas reações foram feitas as seguintes afirmações:
I. As duas reações podem ser classificadas como de oxirredução.
II. O dióxido de manganês (MnO2 ) atua como agente oxidante na segunda reação.
III. Na segunda reação, nem todos os átomos de cloro presentes no HCl sofrem variação de Nox.
IV. O ácido clorídrico (HCl) é considerado um ácido fraco.
Estão corretas apenas as afirmações

II) A etapa 2 de separação dos gases ocorre por liquefação seguida de destilação fracionada.
III) O processo Haber-Bosch consiste em uma reação de síntese total.
IV)Asoma dos coeficientes mínimos e inteiros da equação na etapa 4 é 19.
V) A etapa 4 é uma reação catalítica de oxirredução.
A sequência correta que corresponde, respectivamente, à questão é
I. 2H2S(g) + H2SO3(aq) ➡︎ 3S(s) + 3H2O(l) II. H2S(g) + 2H+(aq) + SO42-(aq) ➡︎ SO2(g) + S(s) + 2H2O(l) III. H2S(g) + Pb(s) ➡︎ PbS(s) + H2(g) IV. 2H2S(g) + 4Ag(s) + O2(g) ➡︎ 2Ag2S(s) + 2H2O(l)
Nas reações representadas pelas equações acima, o sulfeto de hidrogênio é agente redutor em:
I. 2H2S(g) + H2SO3(aq) ↠ 3S(s) + 3H2O(l) II. H2S(g) + 2H+(aq) + SO4 2-(aq) ↠ SO2(g) + S(s) + 2H2O(l) III. H2S(g) + Pb(s) ↠ PbS(s) + H2(g) IV. 2H2S(g) + 4Ag(s) + O2(g) ↠ 2Ag‚S(s) + 2H2O(l)
Nas reações representadas pelas equações acima, o sulfeto de hidrogênio é agente redutor em:
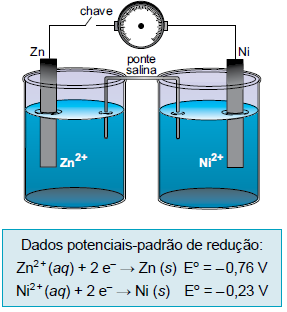
O catodo e a diferença de potencial da pilha são, respectivamente,
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Reação 1: 2 H2(g) → 4 H+ (aq) + 4e-
Reação 2: O2(g) + 4 H+ aq) + 4e- → 2 H2O(l)
Sobre células a combustível, marque a afirmação verdadeira.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
As2S3 +HNO3 + H2O → H3AsO4 + H2SO4 +NO,
marque a única afirmação verdadeira.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
HNO3(l) + SO2(g) + H2O(l) → H2SO4(l) + NO(g)
são feitas as seguintes afirmações:
I. O nitrogênio sofre redução. II. O enxofre ganha elétrons. III. O agente redutor é o SO2. IV. O agente oxidante é o HNO3.
São corretas as seguintes afirmativas:
Já naquela época, com base nesse experimento, sugeriu-se que as forças responsáveis pelas ligações químicas apresentam a seguinte natureza:
Fontes alternativas de energia têm sido foco de interesse global como a solução viável para crescentes problemas do uso de combustíveis fósseis. Um exemplo é a célula a combustível microbiológica que emprega como combustível a urina. Em seu interior, compostos contidos na urina, como ureia e resíduos de proteínas, são transformados por micro-organismos que constituem um biofilme no anodo de uma célula eletroquímica que produz corrente elétrica.
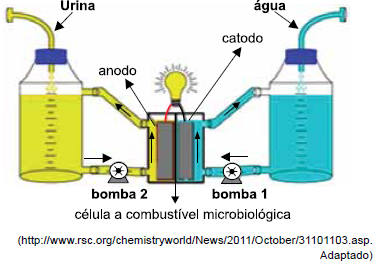
Sobre essa célula eletroquímica, é correto afirmar que, quando
ela entra em operação com a geração de energia elétrica, o
biofilme promove a
Dado: Constante de Faraday = 96500 C • mol‒1.
CO(g) + H2(g) → H3 COH(g)
Nesta equação