Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Baterias secundárias são geradores de energia elétrica, do tipo não recarregável.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Durante o funcionamento das baterias de hidreto metálico, o número de oxidação do
hidrogênio permanece constante, igual a +1.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Nas baterias de hidreto metálico, o material ativo é o agente oxidante.
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:
No interior do casco dos navios, existem tanques que podem ter seu volume preenchido parcial ou totalmente com água do mar em função das necessidades de flutuabilidade.
Como os tanques são constituídos de materiais metálicos, eles sofrem, ao longo do tempo, corrosão pelo contato com a água do mar, conforme a equação:
4 Fe (s) + 3 O2 (g) 2 Fe2 O3 (s)
Um processo corrosivo no interior de um tanque fechado apresenta as seguintes características:

Admita que, durante todo o processo de corrosão, o ar no interior do tanque esteve submetido
às CNTP, com comportamento ideal, e que apenas o oxigênio presente no ar foi consumido.
A bateria de níquel-cádmio (pilha seca), usada rotineiramente em dispositivos eletrônicos, apresenta a seguinte reação de oxirredução
Cd(s) + NiO2(s) + 2 H2O (l) → Cd(OH)2(s) + Ni(OH)2(s)
O agente oxidante e o agente redutor dessa reação, respectivamente, são:
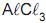 , a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a:
, a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a: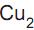 e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.
e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce. Sobre o cobre e seus óxidos, é CORRETO afirmar que:
Desenvolveu-se, recentemente, uma bateria com uma grande capacidade de carga e número de ciclos, além de rapidez de recarga. Simplificadamente, no funcionamento dessa bateria ocorre uma deposição de lítio metálico num eletrodo de estanho e carbono (Sn/C), enquanto num eletrodo de carbono e sulfeto de lítio (Li2S/C) liberam-se o íon lítio e o enxofre elementar. Considerando essas informações, pode-se afirmar que no funcionamento da bateria ocorre
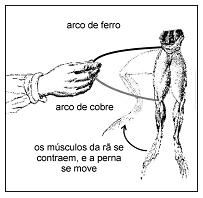
Interpretando essa observação com os conhecimentos atuais, pode-se dizer que as pernas da rã continham soluções diluídas de sais. Pode-se, também, fazer uma analogia entre o fenômeno observado e o funcionamento de uma pilha.
Considerando essas informações, foram feitas as seguintes afirmações:
I. Devido à diferença de potencial entre os dois metais, que estão em contato entre si e em contato com a solução salina da perna da rã, surge uma corrente elétrica.
II. Nos metais, a corrente elétrica consiste em um fluxo de elétrons.
III. Nos músculos da rã, há um fluxo de íons associado ao movimento de contração.
Está correto o que se afirma em
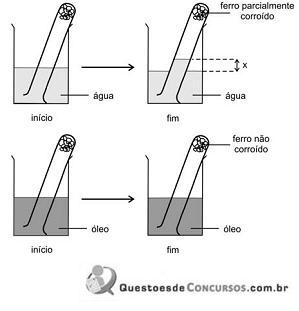
Sobre tal experimento, considere as seguintes afirmações:
I. Com base na variação (x) de altura da coluna de água dentro do primeiro tubo de ensaio, é possível estimar a porcentagem de oxigênio no ar.
II. Se o experimento for repetido com massa maior de fios de ferro, a diferença entre o nível da água no primeiro tubo e no recipiente será maior que x.
III. O segundo tubo foi mergulhado no recipiente com óleo a fim de avaliar a influência da água no processo de corrosão.
Está correto o que se afirma em
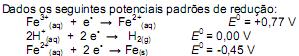
Assinale a alternativa correspondente à equação química correta e referente à reação que deverá ocorrer espontaneamente:
Ca10(PO4)6OH2(s)+H+ (aq) ↔Ca2+ (aq)+HPO4 2– (aq)+ H2O(l)
A reação direta, que enfraquece o esmalte e produz a cárie, é conhecida como desmineralização, e a reação inversa como mineralização.
Sobre o sistema acima indicado, assinale a afirmação FALSA.
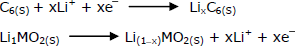
A respeito dessas semirreações pode-se afirmar corretamente que

