Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões


O potencial total para essa pilha é:
Para tanto, cada um desses metais foi mergulhado em três soluções diferentes ? uma de nitrato de cobre,
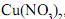 , uma de nitrato de magnésio,
, uma de nitrato de magnésio,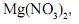 , e uma de nitrato de zinco,
, e uma de nitrato de zinco, 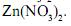 .
. Neste quadro, estão resumidas as observações feitas ao longo dos testes:
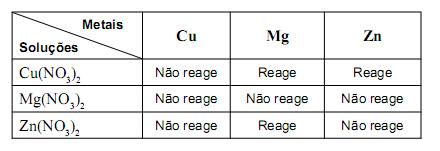
Considerando-se essas informações, é CORREtO afrmar que a disposição dos três metais testados, segundo a ordem crescente de reatividade de cada um deles, é
Considere uma bateria de chumbo com ddp de 12 V. As duas
semi-reações não-balanceadas dessa bateria são apresentadas a seguir.

Com relação a essas reações, julgue os próximos itens.
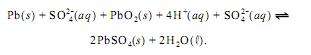
Sabendo que o potencial de redução da reação I, quando balanceada, é -0,35 V, calcule, em volts, o potencial de redução da reação II balanceada. Multiplique o valor obtido por 100, e desconsidere, para a marcação na folha de respostas, a parte fracionária do resultado final obtido, após realizar todos os cálculos solicitados.
( a resposta é 165 ).
Considere uma bateria de chumbo com ddp de 12 V. As duas
semi-reações não-balanceadas dessa bateria são apresentadas a seguir.

Com relação a essas reações, julgue os próximos itens.
Considere uma bateria de chumbo com ddp de 12 V. As duas
semi-reações não-balanceadas dessa bateria são apresentadas a seguir.

Com relação a essas reações, julgue os próximos itens.

Com base no diagrama da célula combustível, pode-se afirmar que:

Com base nessas informações, pode-se afirmar que:

Assinale a opção correta.
Na reação representada pela equação: após o balanceamento, o coeficiente do agente oxidante
será
após o balanceamento, o coeficiente do agente oxidante
será
Um esquema simplificado de uma célula a combustível de H2 / O2 é:
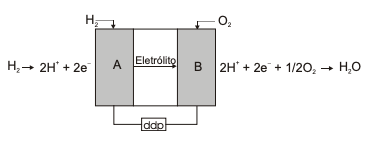
Quando os eletrodos A e B estão em equilíbrio, Ε°red = 0,00 V, para A, e Ε°red = 1,23 V, para B, sendo Ε°red o potencial padrão de redução.
Sabendo-se que a reação global de tal célula possui ∆G° = -237 KJ/mol e ∆H° = -286 KJ/mol, a 25°C, é correto afirmar que, na célula a combustível, ocorre um processo
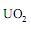 (s) em
(s) em 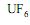 (g), pode-se afirmar que:
(g), pode-se afirmar que: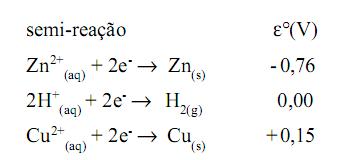
Julgue as afirmações a seguir usando (C) para certo e (E) para errado com base nas informações fornecidas:
( ) O suco do limão fará o papel de uma solução eletrolítica, que geralmente é alguma solução iônica. O caráter iônico possibilita que íons livres se movimentem no interior da mistura.
( ) O suco do limão é um meio básico, devido à grande concentração de ácido cítrico do limão, ácido fraco, pois o ânion produzido da dissociação do ácido reage com a água produzindo íons OH- , responsável pela basicidade do meio.
( ) Quando se insere o eletrodo de cobre no limão ocorre reação química entre a placa de cobre e os íons H+, produzindo íons Cu2+ e gás hidrogênio.
( ) Quando se insere o eletrodo de zinco no limão ocorre reação química entre os átomos de zinco e os íons H+, produzindo íons Zn2+ e o H2(g) .
( ) Os elétrons migram da placa de cobre para a placa de zinco a fim de reduzir os íons H+. A redução de dois íons H+ dá origem a uma molécula de H2 (gás hidrogênio).
( ) Ao fechar o circuito elétrico, os elétrons livres na placa de zinco, pólo negativo, se dirigem pelo fio até a placa de cobre, pólo positivo. Então, os átomos de zinco migram da placa para o suco do limão, perdendo dois elétrons cada um, que irão fazer parte da corrente elétrica.
( ) Nenhuma reação química é responsável pela produção da corrente elétrica que faz o relógio funcionar. Afinal, as substâncias são apenas matéria e não energia.
Assinale a alternativa que representa a seqüência correta.

Nestas fguras, estão representados, esquematicamente, os materiais então utilizados por eles:
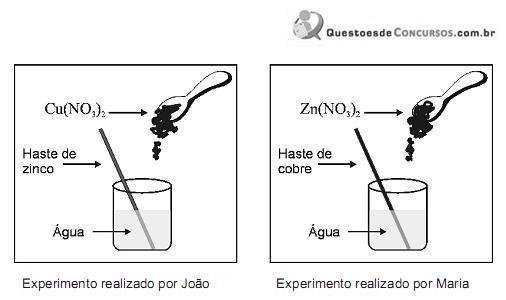
Para facilitar a dissolução de nitrato de cobre em água, João usou uma haste de zinco. No fnal do experimento, a haste estava corroída e formou-se uma solução incolor e um sólido, que, após algum tempo, se depositou no fundo do recipiente.
Maria, por sua vez, utilizou uma haste de cobre para dissolver nitrato de zinco em água. No fnal do experimento, ela obteve uma solução incolor e a haste manteve- se intacta.
Sabe-se que as soluções aquosas de nitrato de cobre (II),
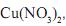 são azuis e que as de nitrato de zinco (II),
são azuis e que as de nitrato de zinco (II), 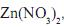 são incolores.
são incolores. Considerando-se os dois experimentos descritos, é CORRETO afrmar que
Alguns dos processos físicos, químicos e bioquímicos que ocorrem com o mercúrio, após seu lançamento no ambiente, estão representados nesta figura:
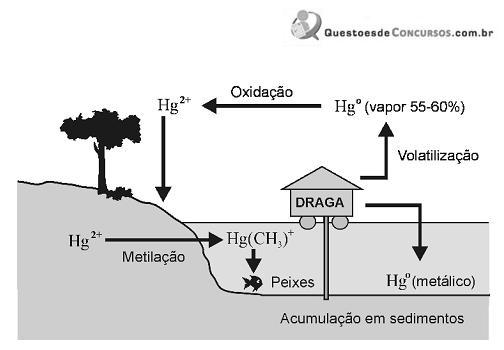
Considerando-se as informações fornecidas por essa figura e outros conhecimentos sobre o assunto, é CORRETO afirmar que
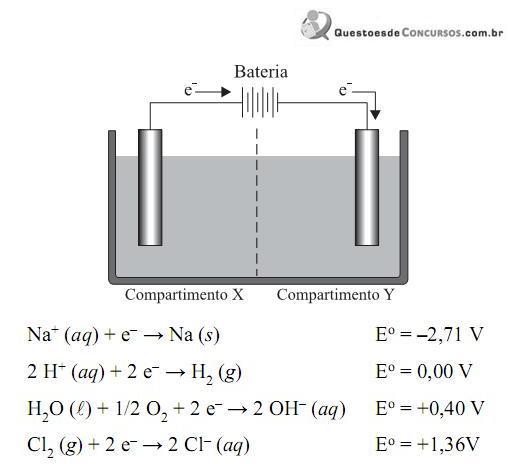
Para essa célula, foram feitas as seguintes afirmações:
I. O pólo positivo é o eletrodo do compartimento Y.
II. O ânodo é o eletrodo do compartimento X.
III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.
IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.
V. Na eletrólise da solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.
São corretas somente as afirmações
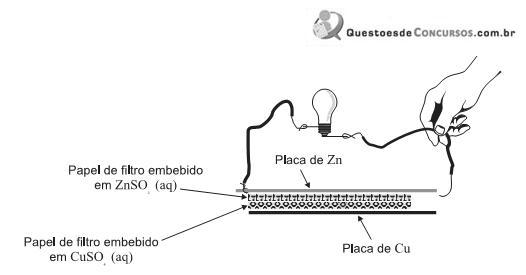
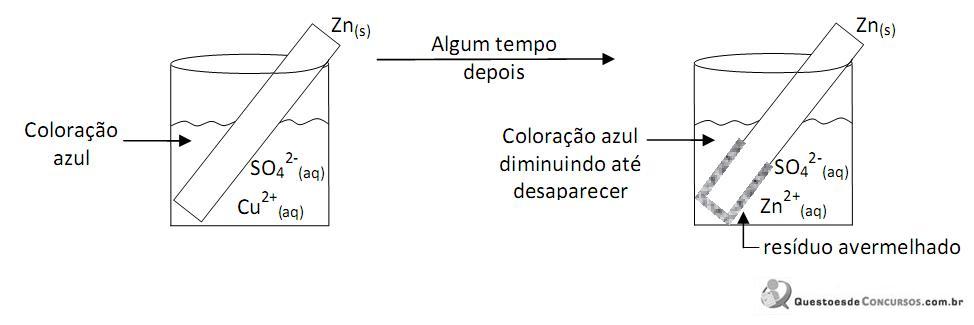
A bateria é construída com placas de zinco e de cobre, entre as quais, são dispostas soluções aquosas de sulfato de zinco e de sulfato de cobre, embebidas em papel de filtro.
Considerando-se o funcionamento dessa bateria, é INCORRETO afirmar que,

