Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 419 questões
dado: constante de Faraday: F = 96.500C/mol.
Nos aparelhos portáteis modernos, usados com freqüência na atualidade, como filmadoras, computadores, máquinas fotográficas digitais e telefones celulares, as baterias de íons de lítio vêm sendo cada vez mais utilizadas, porque possuem inúmeras vantagens frente a outros modelos, dentre eles as de níquel e cádmio e níquel metal hidreto. Além de armazenarem muito mais energia, as baterias de lítio proporcionam um tempo maior de uso sem recarga, são mais leves, não são afetadas pelo efeito memória e podem ser recarregadas sem a necessidade de esperar a descarga total. Isso sem falar que ainda diminuem o risco ambiental, principalmente quando comparadas às baterias que contém cádmio, que é um metal pesado que produz graves efeitos tóxicos aos organismos vivos, mesmo em concentrações muito pequenas.
A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio. 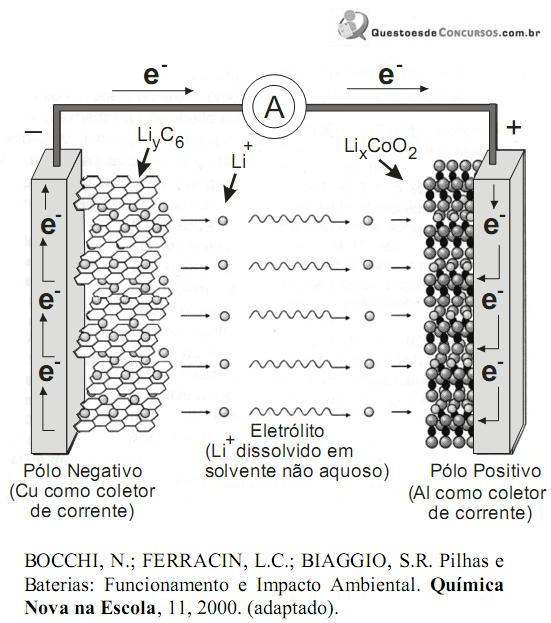
Dessa forma, na descarga da bateria, as reações químicas nos dois pólos são:
Pólo Negativo:
LiyC6 (s) → C6 (s) + y Li+ (solv.) + y e-
Pólo Positivo:
LixCoO2(s) + y li+ (solv.) + y e- → lix+yCoO2(s)
Sobre tais reações, pode-se dizer que:
Observa-se que a chave fica amarela por causa da
Dissolveu uma pequena quantidade do sal de cozinha em 300mL de água e introduziu na solução preparada um fio de cobre polido. Considerando os valores de potencial de redução padrão a seguir :
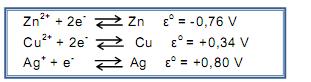
pode-se afirmar que o teste permite identificar
Dissolveu uma pequena quantidade do sal de cozinha em 300mL de água e introduziu na solução preparada um fio de cobre polido. Considerando os valores de potencial de redução padrão a seguir :
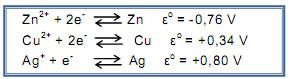
pode-se afirmar que o teste permite identificar
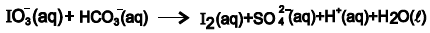
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Eº (Al3+/Al) = –1,66 V Eº (Sn2+/Sn) = –0,14 V
Escolha a alternativa correspondente às associações corretas:

2 MnO2(s) + H2O(l) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq) Zn(s) + 2 OH⁻(aq) → Zn(OH)2(s) + 2e⁻
Sobre essa pilha, é incorreto afirmar que:
Com base nesta informação, podemos afirmar que as substâncias adicionais promoverão:

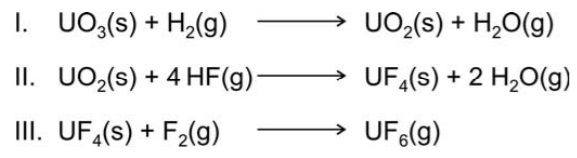
Sobre tais transformações, pode-se afirmar, corretamente, que ocorre oxirredução apenas em
MH + NiO(OH) → M + Ni(OH)

,com uma diferença de potencial de saída de 1,35 V. Teoricamente, a tensão mínima, em volts, que se deve aplicar para recarregar essa bateria é de:
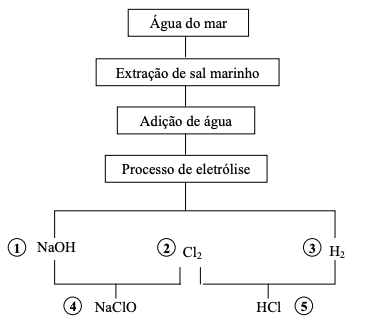
A partir dessas informações, analise as afirmativas.
I - O subproduto 1 da eletrólise é o hidróxido de sódio, conhecido como soda cáustica, matéria-prima utilizada na fabricação de sabão, detergentes e papel. II - Para obtenção de 36,5 g do subproduto 5 são necessários 0,5 mol de H2 e 0,5 mol de Cl2. III - A eletrólise ocorrida entre o sal marinho e a água é uma reação espontânea, sem necessidade de energia para a sua realização. IV - O subproduto 4 é utilizado para lavagem de roupas coloridas. V - O subproduto 3 é extremamente reativo e perigoso, utilizado na produção de amônia.
Estão corretas as afirmativas
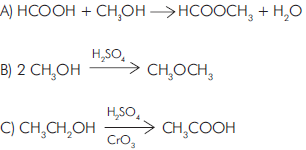
( ) O potencial padrão de redução do alumínio (E° = −1,66V) mostra que ele é facilmente oxidado. ( ) A resistência do alumínio à corrosão deve-se à formação de uma camada fina, dura e transparente de Al2O3 que adere à superfície do metal. ( ) A quantidade de matéria de alumínio necessária para se obter 204g de Al2O3 é 2,5 mols. ( ) O átomo de alumínio possui número atômico 13 e massa 26,98u.
Assinale a seqüência correta.


O potencial total para essa pilha é: