Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 419 questões
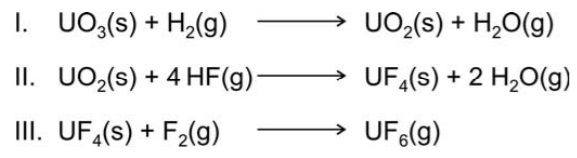
Sobre tais transformações, pode-se afirmar, corretamente, que ocorre oxirredução apenas em
Essas pilhas usam, como eletrólito, o KOH(aq), de modo que todas as reações ocorrem em meio alcalino. A troca de elétrons se dá na superfície de um material poroso. Um esquema dessas pilhas, com o material poroso representado na cor cinza, é apresentado a seguir.
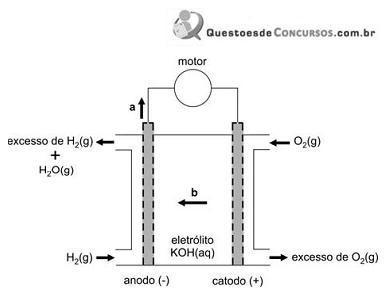
Escrevendo as equações das semirreações que ocorrem nessas pilhas de combustível, verifica-se que, nesse esquema, as setas com as letras a e b indicam, respectivamente, o sentido de movimento dos


A obtenção do silício para uso na fabricação de processadores envolve uma série de etapas. Na primeira, obtém-se o silício metalúrgico, por reação do óxido com coque, em forno de arco elétrico, à temperatura superior a 1 900 ºC. Uma das equações que descreve o processo de obtenção do silício é apresentada a seguir:
SiO2 (s) + 2C(s) → Si(L) + 2CO(g)
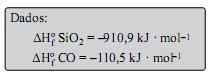
De acordo com as informações do texto, é correto afirmar que o processo descrito para a obtenção do silício metalúrgico corresponde a uma reação
I. As reações envolvidas nesse processo são de óxido-redução.
II. O escurecimento do objeto de prata se deve a prata na sua forma oxidada.
III. A prata volta a brilhar porque sofre uma reação de oxidação e volta para a sua forma metálica (Ag).
IV. A prata volta a brilhar porque sofre uma reação de redução e volta para a sua forma metálica (Ag).
V. O alumínio é extremamente necessário, pois participa da reação que envolve transferência de elétrons.
verifica-se que estão corretos apenas
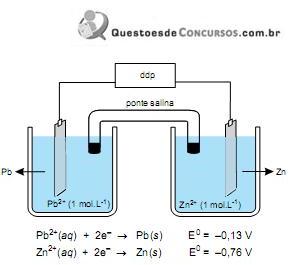
A partir da análise da figura, é correto afirmar que essa pilha tem ddp igual a
Desenvolveu-se, recentemente, uma bateria com uma grande capacidade de carga e número de ciclos, além de rapidez de recarga. Simplificadamente, no funcionamento dessa bateria ocorre uma deposição de lítio metálico num eletrodo de estanho e carbono (Sn/C), enquanto num eletrodo de carbono e sulfeto de lítio (Li2S/C) liberam-se o íon lítio e o enxofre elementar. Considerando essas informações, pode-se afirmar que no funcionamento da bateria ocorre
É possível construir uma pilha eletroquímica colocando em um copo de vidro papel alumínio amassado, palha de aço e papel amassado para separar os dois metais. É necessário que os metais e o papel estejam submersos em uma solução de cloreto de sódio (sal de cozinha). Ligando-se um fo no alumínio e outro na palha de aço e conectando-os aos polos de um relógio digital comum de parede, é possível fazê-lo funcionar por algum tempo.
As equações parciais propostas para essa reação são:
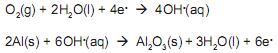
As informações apresentadas permitem concluir que

Sobre essa tentativa de síntese da quinina de Perkin, é correto afirmar que
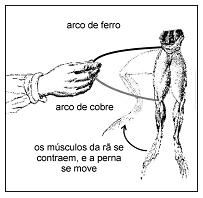
Interpretando essa observação com os conhecimentos atuais, pode-se dizer que as pernas da rã continham soluções diluídas de sais. Pode-se, também, fazer uma analogia entre o fenômeno observado e o funcionamento de uma pilha.
Considerando essas informações, foram feitas as seguintes afirmações:
I. Devido à diferença de potencial entre os dois metais, que estão em contato entre si e em contato com a solução salina da perna da rã, surge uma corrente elétrica.
II. Nos metais, a corrente elétrica consiste em um fluxo de elétrons.
III. Nos músculos da rã, há um fluxo de íons associado ao movimento de contração.
Está correto o que se afirma em
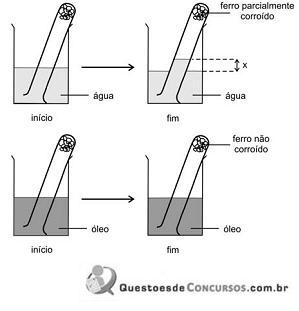
Sobre tal experimento, considere as seguintes afirmações:
I. Com base na variação (x) de altura da coluna de água dentro do primeiro tubo de ensaio, é possível estimar a porcentagem de oxigênio no ar.
II. Se o experimento for repetido com massa maior de fios de ferro, a diferença entre o nível da água no primeiro tubo e no recipiente será maior que x.
III. O segundo tubo foi mergulhado no recipiente com óleo a fim de avaliar a influência da água no processo de corrosão.
Está correto o que se afirma em
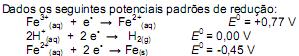
Assinale a alternativa correspondente à equação química correta e referente à reação que deverá ocorrer espontaneamente:
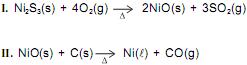
Um dos processos de obtenção do níquel, metal utilizado na fabricação de moedas, consiste, inicialmente, no aquecimento de sulfeto de níquel(III) na presença de ar. Durante esse processo, são formados óxido de níquel(II) e de dióxido de enxofre, de acordo com a equação química I, e, posteriormente, o NiO(s) reage com o carvão, em forno siderúrgico, com obtenção do níquel metálico e do monóxido de carbono, conforme reação representada na equação química II.
Considerando-se as informações do texto e as equações químicas I e II que representam, resumidamente, esse processo, é correto afirmar:

