Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 422 questões
Dados:
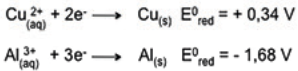

Considere as afirmações abaixo, sobre os dados da tabela.
I - O lítio metálico é um forte agente redutor. II - O cátion prata pode oxidar o cobre metálico para Cu2+ . III- O zinco é o ânodo em uma pilha com eletrodos de zinco e chumbo.
Quais estão corretas?
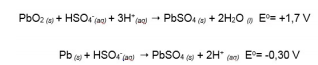
Analise as alternativas abaixo selecionadas com as semi-reações (1) e (2). I. Na Equação 1, é onde ocorre a reação de oxidação, e na Equação 2 a reação de redução. II. A Equação 1 pode ser identificada como anodo e a Equação 2 o catodo. III. No processo eletroquímico, estão envolvidos 2 mols de elétrons. IV. O chumbo é agente redutor e, também, agente oxidante. V. A célula voltaica gera 2 Volts.
Está incorreto o que se afirma em
Al+ 3 + 3e → Al (-1,66 V) Fe+2 + 2e → Fe (-0,44 V),
a ddp da pilha Al ; Al+3 ; Fe+2 ; Fe, em condições - padrão, é:
A pilha seca foi inventada e patenteada em 1866 pelo engenheiro francês Georges Leclanché. A pilha de Leclanché é a precursora das pilhas secas modernas, podendo ser utilizadas em lanternas, rádios portáteis, gravadores, brinquedos etc. As reações que ocorrem na pilha seca são as seguintes:
No cátodo:
2 MnO2(s)+2 NH4 + (aq)+2 e−→ Mn2O3(s)+2 NH3 (aq)+ H2O(l) E° = 0,737 V
No ânodo:
Zn → Zn2+ + 2 e− E° = − 0,763 V
Qual é a máxima variação de potencial (ΔE) obtida nesta pilha?
C6H12O6(s) + 6 O2(g) → 6 CO2(g) + 6 H2O(l) + calor
Quando 1 mol de glicose reage, quantos mols de elétrons são transferidos nesta reação redox?
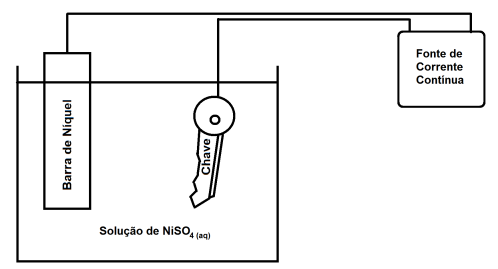
No processo de revestimento da chave com níquel ocorrerá, majoritariamente, uma reação de X, representada por uma semirreação Y. Nesse caso, o par X,Y pode ser representado por
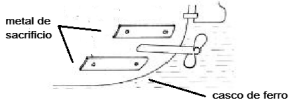 Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada).
Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada). Considerando a equação de redução do ferro: Fe+2 + 2e- → Fe° Eº = - 0,44 V Assinale a alternativa que apresenta um metal de sacrifício que poderia ser usado nas plaquetas fixadas ao casco do navio, de forma a proteger o ferro da oxidação.
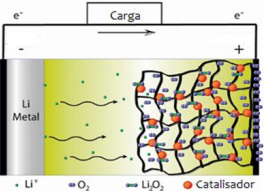 Disponível em: http://sciencewatch.com/ Adaptado
Disponível em: http://sciencewatch.com/ Adaptado Geradores desse tipo
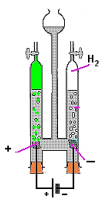
Fonte: http://www.docbrown.info/page01/ExIndChem/electrochemistry03.htm. Adaptado
A substância produzida no ânodo é um
I. Alumínio II. Ferro III. Níquel IV. Cobre V. Prata
Assinale a alternativa que apresenta somente materiais em que a solução pode ser armazenada sem ocorrência de reação com o recipiente:
Dados:
Al3+(aq) + 2e- → Al(s) E°=-1,66 V Fe2+(aq) + 2e- → Fe(s) E°=-0,44 V Ni2+(aq) + 2e- → Ni(s) E°=-0,25 V Co2+(aq) + 2e- → Co(s) E°=-0,28 V Cu2+(aq) + 2e- → Cu(s) E°=+0,34 V Ag+(aq) + 2e- → Ag(s) E°=+0,80 V
2 H2O + 2 e- → H2 + 2 OH- E° = - 0,828 V ½ O2 + H2O + 2 e- → OH- E° = + 0,401 V
Levando-se em conta essas informações e as assertivas a seguir,
I. A reação global da pilha de combustível é H2 + ½ O2 → H2O II. O hidrogênio sofre oxidação no processo. III. A diferença de potencial da pilha de combustível, em condição padrão, é igual a 1,229 V. IV. O gás oxigênio (O2) é o agente redutor.
Pode-se afirmar que estão CORRETAS apenas:

Durante o funcionamento do circuito, é correto afirmar que ocorre
Um aluno mergulhou uma bobina de cobre (6,00 g) em uma solução de nitrato de prata (2,0 g dissolvidos em solução aquosa para 50 mL de volume total). Ele observou, após a ocorrência da reação, a deposição de um sólido acinzentado sobre a bobina de cobre, e também notou que a solução adquiriu uma coloração azul. A massa do sólido cinza foi de 1,2 g e a massa da bobina 5,50 g. As equações abaixo podem ser utilizadas para descrever a reação que ocorre no experimento:
Cu2+(aq) + 2e- → Cu(s) Eº = +0,52 V
Ag+ (aq) + e- → Ag(s) Eº = +0,80 V
2Ag+ (aq) + Cu(s) → 2Ag(s) + Cu2+(aq)
Analise as proposições em relação às informações e às equações acima.
I. A concentração da solução de nitrato de prata é 0,2 mol/L
II. Essa reação pode ser considerada uma pilha com um ΔEº = 0,28 V.
III. A prata oxida nessa reação.
IV. O sólido que se deposita sobre a bobina de cobre é de prata metálica.
V. O cobre é o agente redutor, sofrendo redução.
VI. A quantidade de prata produzida (sólido cinza) foi de 0,011 mol e a quantidade de cobre consumida 0,0079 mol.
Assinale a alternativa correta
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
KMnO4 (s) + HCl (aq) → KCl (aq) + MnCl2 (aq) + Cl2 (g) + H2O (l)
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.
A. H2SO4 (aq) + NaOH (aq) → NaHSO4 (aq) + H2O (l) B. H2SO4 (aq) + BaCl2 (aq) → BaSO4 (s) + HCl (aq) C. H2SO4 (aq) + (NH4)2CO3 (aq) → (NH4)2SO4 (aq) + H2O (l) + CO2 (g)
Sobre essas reações, analise as proposições
I. A reação A é uma reação de neutralização, entre um ácido forte e uma base forte. II. Os coeficientes estequiométricos para a reação B são 1:2:1:2 III. A reação B é uma reação de oxirredução e está balanceada corretamente. IV. A reação C é uma reação de precipitação. V. Os coeficientes estequiométricos para a reação C são 1: 1: 1: 1: 1. VI. A reação A está balanceada e os coeficientes estequiométricos são 1:1:1:1.
Assinale a alternativa correta.
Fe2+(aq) + 2e- ➡ Fe(s) E°red = -0,44 V Zn2+(aq) + 2e- ➡ Zn(s) E°red = -0,76 V
Analise as proposições sobre o ferro galvanizado, levando em consideração as semirreações acima.
I. Como o valor de E°red para a redução do Fe2+ é maior que aquele para a redução do Zn2+ , Fe2+ é mais facilmente reduzido que Zn2+ . II. O Zn(s) é mais facilmente oxidado que Fe(s). III. Quando o ferro galvanizado é exposto ao oxigênio e à água, o zinco funciona como ânodo e é corroído em vez do ferro. IV. Quando o ferro galvanizado é exposto ao oxigênio e à água, o ferro funciona como cátodo no qual o O2 é reduzido.
Assinale a alternativa correta.
Fonte: <https://www.carrodegaragem.com/kit-hidrogenio-veicular-moto-funciona/ >(Adaptado)
Sabemos que a energia proveniente da combustão do hidrogênio vale 1/30 kWh por grama.
Analisando essas informações, assinale a afirmativa INCORRETA em relação ao kit hidrogênio:
Observe a reação abaixo, que representa a adição de uma solução de permanganato de potássio em uma solução de ácido clorídrico.
KMnO4(aq) + HCI(aq) -> KCI(aq) + MnCl2(aq) + Cl2(g) + H2O(I)
O coeficiente estequiométrico do ácido clorídrico
da reação balanceada é

