Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 418 questões
O metal alumínio (Al) é largamente usado na produção de latinhas de refrigerante e cerveja, janelas e portas, papel alumínio, etc. Industrialmente, o alumínio é obtido através da eletrólise ígnea do óxido de alumínio extraído do minério bauxita. No processo são usados eletrodos de grafite (C), que são gastos durante a eletrólise e substituídos por novos eletrodos a cada 20 dias aproximadamente. O uso dos eletrodos de grafite gera um subproduto que acarreta intensificação do efeito estufa da atmosfera terrestre.
Com base no texto, são feitas as seguintes afirmativas:
I. A fórmula do óxido de alumínio é Al3 O2 .
II. O alumínio metálico é formado no ânodo da célula eletrolítica.
III. O subproduto que causa problemas ambientais é o dióxido de carbono.
Está/Estão correta(s) apenas a(s) afirmativa(s)

(P) NaCl
(Q) CaCO3
(R) H3 PO4
(S) SiO2 (I) produção de vidros (II) composição de xarope de bebida refrigerante (III) correção das condições do solo para plantio (IV) produção eletrolítica de soda cáustica
A associação mais correta dos itens da primeira coluna com os da segunda seria
Os metais são materiais sólidos, opacos e bons condutores de calor e eletricidade. Podem também ser transformados em lâminas, sendo usados para fabricar embalagens, como o cobre, o estanho e o alumínio. Recipientes de alumínio são usados para acondicionar bebidas como cervejas, sucos, refrigerantes etc. A produção desses recipientes de alumínio segue um longo caminho, desde a extração do minério (bauxita) até a sua prensagem, quando voltam para a fundição para serem reciclados. O quadro mostra um resumo do processo de produção de latas de alumínio.
Minério → Beneficiamento → Eletrólise → Fundição → Laminação → Latas → Consumidor → Coleta → Prensagem
MUNHOZ, D.; MAFRA, N.; BAGGIO, A. E. A evolução da embalagem: informações para uma
nova geração de consumidores conscientes. Belo Horizonte: ECO, 2007 (adaptado).
Considerando o quadro, a etapa na qual o minério é transformado em alumínio puro é a
Células a combustível são opções viáveis para gerar energia elétrica para motores e outros dispositivos. O esquema representa uma dessas células e as transformações que nela ocorrem.
H2(g) + ½ O2(g) → H2O(g) ΔH = -240kJ/mol de H2
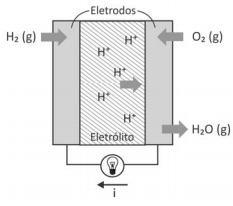
A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo, é
Note e adote:
Carga de um mol de elétrons = 96.500 coulom
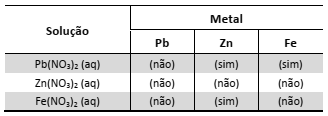
Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:
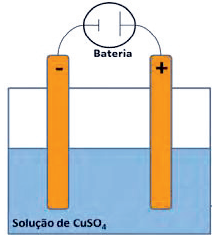
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
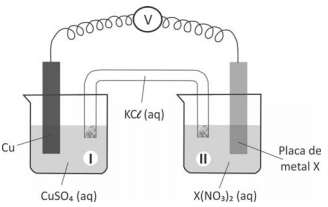
Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq).
Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V.
A atribuição correta desses valores de força eletromotriz a
cada uma das pilhas, de acordo com a reatividade dos metais
testados, deve ser

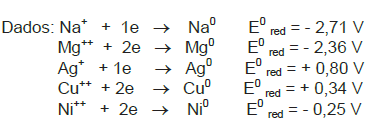
Qual é o sal presente na solução adicionada ao béquer?
Sobre esse processo, são feitas as afirmações a seguir:
I. No catodo (–), que é o cobre puro, ocorre depósito de mais cobre em virtude da redução do Cu2+ .
II. A corrosão faz a solução aumentar a concentração de Cu2+, que é atraído para o catodo, formando cobre metálico livre das impurezas.
III. Uma solução aquosa de NiSO4 aumentaria a deposição de cobre puro no catodo.
IV. No anodo (+), existe a oxidação do cobre metálico.
 Adaptado de:
http://www.acervodigital.unesp.br/bitstream/
123456789/46363/4/2ed_qui_m4d7.pdf
Adaptado de:
http://www.acervodigital.unesp.br/bitstream/
123456789/46363/4/2ed_qui_m4d7.pdf Está CORRETO, apenas, o que se afirma em
Adaptado de: http://noticias.uol.com.br/ciencia/ultimas-noticias/bbc/2016/06/12/ (Acesso em: 20/06/2016)
A seguir, são feitas algumas afirmações sobre possíveis vantagens do sistema.
I. O gás nitrogênio produzido nessa eletrólise é um combustível menos poluente que o hidrogênio.
II. A ureia é decomposta em amônia que é vaporizada no sistema, antes de seguir para alimentar uma célula onde o gás é utilizado como combustível.
III. A energia fornecida para a produção do combustível pode ser menor que a utilizada na eletrólise da água, pois as ligações entre os átomos de hidrogênio e nitrogênio são mais fracas que as ligações entre os átomos da água.
Está CORRETO o que se afirma, apenas, em
Um dos tipos de pilha mais eficientes são as de lítio. A reação redox que ocorre nessas pilhas é, simplificadamente, representada a seguir:
2 Li (s) + I2 (s) → 2 Li+ (aq) + 2 I−(aq)
Dados:
Eo Li+/Li = −3,05 V
Eo I2 /I− = +0,53 V
O ácido sulfídrico, H2S, pode ser eletroquimicamente reagido, produzindo enxofre elementar, segundo a reação abaixo:
H2S(aq) + I2(aq) → S(s) + 2H+(aq) + 2I−aq)
• Dada a reação química balanceada, identifique a espécie que sofre redução, a espécie que sofre oxidação, o agente redutor e o agente oxidante e assinale a alternativa que apresenta a associação correta.
3 Cu(s) + 8HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(I)
Dados:
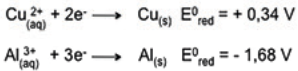

Considere as afirmações abaixo, sobre os dados da tabela.
I - O lítio metálico é um forte agente redutor. II - O cátion prata pode oxidar o cobre metálico para Cu2+ . III- O zinco é o ânodo em uma pilha com eletrodos de zinco e chumbo.
Quais estão corretas?
Quando o ferro ou o aço, já com camada de Fe2O3 , sofre corrosão em presença de umidade, têm-se as reações abaixo, em que Fe3O4 é de fato FeO·Fe2O3
Reação I: Fe → Fe2++ 2e
Reação II: 4 Fe2O3 + Fe2++ 2e → 3 Fe3O4
Nesse processo corrosivo,
A transferência do alumínio da panela para o alimento envolve a:
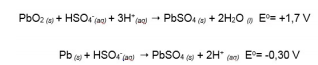
Analise as alternativas abaixo selecionadas com as semi-reações (1) e (2). I. Na Equação 1, é onde ocorre a reação de oxidação, e na Equação 2 a reação de redução. II. A Equação 1 pode ser identificada como anodo e a Equação 2 o catodo. III. No processo eletroquímico, estão envolvidos 2 mols de elétrons. IV. O chumbo é agente redutor e, também, agente oxidante. V. A célula voltaica gera 2 Volts.
Está incorreto o que se afirma em

