Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 418 questões
Assinale a alternativa que apresenta o tempo aproximado que a célula de eletrodeposição deve ser mantida ligada, nas condições apresentadas, para que a propaganda seja verdadeira.
Dados: Massa atômica do ouro = 197 u. Constante de Faraday = 96500 C/mol de e-
Cu2+(aq) + 2e- → Cu(s) Eº = +0,34 V Fe2+ (aq) + 2e- → Fe(s) Eº = -0,44 V Zn2+(aq) + 2e- → Zn(s) Eº = -0,76 V Al3+ (aq) + 3e- → Al(s) Eº = -1,66 V
Considerando os potenciais padrão de redução apresentados, avalie as sentenças abaixo e assinale aquela quimicamente INCORRETA quanto ao processo de corrosão.

A tradição de produzir joias e semi joias em Juazeiro do Norte vem desde os tempos do Padre Cícero. Como a cidade recebia muitos visitantes para casar e não tinham alianças, surgiam daí as primeiras oficinas de joias. A galvanoplastia utiliza a eletrolise em meio aquoso para cobrir uma determinada peça metálica com outro metal. Na prateação (Ag + ) de uma aliança, fez-se passar pelas células uma corrente de 3,72 ampères durante 20 minutos. Qual a massa de prata, depositada na superfície da aliança. Dados Ag = 108
Analise as reações.
Reação 1 – Obtenção de água sanitária
Cℓ2 (g) + 2NaOH (aq) → NaCℓ O (aq) + NaCℓ (aq) + H2O (ℓ)
Reação 2 – Reação de carga de uma bateria chumbo/ácido
2PbSO4 (s) + 2H2O (ℓ) → Pb (s) + PbO2 (s) + 2H2SO4 (aq)
Reação 3 – Combustão de magnésio metálico
Mg (s) + 1/2 O2 (g) → MgO (s)
Reação 4 – Obtenção de cal
CaCO3 (s) → CaO (s) + CO2 (g)
São exemplos de oxirredução, que apresentam um reagente atuando simultaneamente como oxidante e redutor, as
reações
Em relação aos processos de obtenção de metais a partir de minerais, e com base nos conhecimentos sobre reações de oxidorredução, considere as afirmativas a seguir.
I. Alo (s) pode ser obtido a partir de bauxita (Al2O3.H2O ) por meio de um método eletrolítico, o qual é baseado num processo não espontâneo onde Al3+ é reduzido a Alo (s). II. Cuo (s) pode ser obtido a partir da queima de sulfeto de cobre, conforme reação Cu2S(s) + O2(g) → 2Cu(s) + SO2(g), onde o número de oxidação do cobre muda de (1+) para (0). III. Feo (s) pode ser obtido a partir de reações de redução de óxidos de ferro conforme transformações químicas: Fe2O3(s) → FeO2(s) → Feo (s). IV. Mno (s) pode ser obtido a partir da reação MnO2(s)+ C(s) → Mn(s) + CO2(g) em que o átomo de oxigênio em MnO2(s) é o redutor e o carbono (C) é o oxidante.
Assinale a alternativa correta.
ENGENHEIRAS DO CHILE CRIAM TECNOLOGIA QUE
RECARREGA BATERIAS COM PLANTAS
Uma tecnologia vinda do Chile pode ser uma alternativa curiosa para a recarga de dispositivos eletrônicos: com ela, em vez de ir atrás de uma tomada, você precisa procurar uma planta.
Trata-se do projeto E-Kaia, que começou como um trabalho universitário de três amigas e se transformou em uma startup que já acumula prêmios mesmo sem o produto no mercado. O E-Kaia captura energia de plantas utilizando uma “placa de biocircuitos” e só precisa ser “enterrado” em um local de cultivo de uma planta bem cuidada. Aparentemente, o sistema recupera energia restante da fotossíntese e é capaz de fornecer 5 volts a 0,5 ampere.
O grupo afirma que a planta também não apresentou problemas de crescimento ou atraiu fungos e pragas. Gadgets e LEDs de baixo consumo podem receber a energia, embora a velocidade de recarga não tenha sido divulgada.
Disponível em: http://www.tecmundo.com.br/bateria/85844-engenheiraschile-criam-tecnologia-recarrega-baterias-plantas.htm. Acesso em: 13 de setembro de 2015. Adaptado.
[Dados: M(Cu) = 63,5 g/mol; 1F = 96500 C/mol de elétrons.]
De acordo com o texto, qual a massa máxima de cobre que pode ser depositada após 38600 s de processo eletrolítico?
A água oxigenada é utilizada como agente antisséptico devido à produção de gás oxigênio na sua decomposição, que ocorre conforme a equação
2H2O2(l) → 2H2O(l) + O2(g)
Essa equação indica que a espécie ganhadora de elétrons é
Dadas as equações químicas balanceadas:
Fe(s) ➜ Fe2+(aq) + 2e- (oxidação)
O2(g) + 2H2O(l) + 4e- ➜ 4OH- (redução)
A equação química balanceada que descreve a oxidação do ferro em meio aquoso neutro será:
Os Marca-passos Cardíacos Artificiais (MP) são dispositivos eletrônicos de estimulação multiprogramável capazes de substituir impulsos elétricos e/ou ritmos ectópicos, para se obter atividade elétrica cardíaca mais fisiológica. Foram introduzidos na prática médica entre 1958 e 1960, o que marcou o início de nova fase no tratamento de cardiopatias.
Disponível em: <http://www.scielo.br/pdf/rba/v53n6/v53n6a15.pdf>. Acesso em: 30 out. 2018.
Há vários tipos de marca-passos, sendo um deles uma pilha que usa lítio e iodo como eletrodos. A seguir são fornecidas, de forma simplificada, as semirreações com os respectivos potenciais de redução das espécies envolvidas no funcionamento dessa pilha:
Li+ + e– → Li E° = – 3,05 V I2 + 2 e – → 2 I – E° = + 0,54 V
Dado: massas atômicas: Li = 7; I = 127
A análise do texto e dos dados permite inferir que
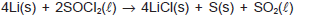
As pilhas de lítio, muito utilizadas em marcapasso, possuem uma grande diferença de potencial, em torno de 3,4V.
Um determinado tipo de pilha de lítio pode ser representada pela equação química global.
Em relação à pilha de lítio, é correto afirmar:
Zn(s) + 2OH- (aq) → Zn (OH)2 + 2e – Mn2O3(s) + 2OH - (aq)
Considerando-se essas informações, pode-se concluir, em relação à pilha alcalina, que
FIGURA 03
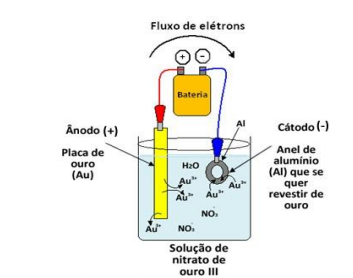
(Disponível em:< https://mundoeducacao.bol.uol.com.br/quimica/galvanoplastia-ou-eletrodeposicao.htm. >Acesso em 28/09/ 2018.)
(Considere: Au = 197g/mol; 1F = 96500 C/mol)
É possível afirmar que a massa de ouro produzida sobre o anel de alumínio, nesta eletrodeposição, foi de:
Após o balanceamento da equação iônica, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Admitindo-se que os potenciais-padrão de redução, E° , do cobre e do cádmio, são, respectivamente, +0,337V e -0,403V, em relação a essa pilha, pode-se afirmar:
O alto forno derrete o minério de ferro e o purifica, transformando-o em um líquido contendo 95% de ferro, chamado de ferro-gusa. A reação química que ocorre na transformação do minério de ferro em ferro-gusa é dada por:
Fe2 O3 (l) + 3 CO (g) → 2 Fe (l) + 3 CO2 (g)
PEIXOTO, D. Fabricação do ferro-gusa e do aço.
Disponível em: www.ifba.edu.br. Acesso em: 8 set. 2013.
A formação de ferro-gusa ocorre através de uma reação de
Um carpinteiro resolveu mexer em sua caixa velha de ferramentas que estava guardada há algum tempo. Ao abri-la, verificou que os pregos estavam enferrujados. O prego é feito de ferro, um metal de fácil oxidação, utilizado na fabricação de várias ferramentas.
Uma das soluções para prevenir a ocorrência desse processo químico é
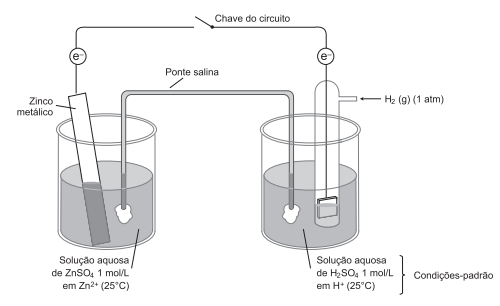
Os estudos sobre os fenômenos da oxirredução tornaram habitual a produção de energia a partir das reações eletroquímicas provenientes de pilhas e de baterias. A grande vantagem desses dispositivos é que são transportadores de energia elétrica e podem ser levados facilmente para qualquer lugar. A figura representa duas meias-células da pilha de zinco e hidrogênio, tendo o hidrogênio potencial-padrão de redução igual a zero.
Considerando-se as informações do texto e da ilustração, é correto afirmar:
Baseado no texto e nas reações acima, juntamente com os conceitos químicos, analise as afirmações a seguir.
I- No cátodo o etanol é oxidado a etanal.
II- No ânodo ocorre uma reação de redução.
III- O sentido da corrente elétrica (i) é do ânodo para o cátodo.
IV- Na reação global corresponde a uma reação de combustão incompleta do etanol.
Assinale a alternativa correta.
(Dados: massa molar do cromo = 52,00 g.mol-1 e constante de Faraday = 96500 C/mol).
Com relação a esse processo assinale a alternativa INCORRETA.