Questões de Vestibular
Sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 418 questões
A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio.

Sobre tais reações, pode-se dizer que:
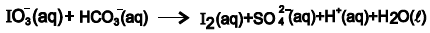
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:

II) A etapa 2 de separação dos gases ocorre por liquefação seguida de destilação fracionada.
III) O processo Haber-Bosch consiste em uma reação de síntese total.
IV)Asoma dos coeficientes mínimos e inteiros da equação na etapa 4 é 19.
V) A etapa 4 é uma reação catalítica de oxirredução.
A sequência correta que corresponde, respectivamente, à questão é
Eº (Al3+/Al) = –1,66 V Eº (Sn2+/Sn) = –0,14 V
Escolha a alternativa correspondente às associações corretas:

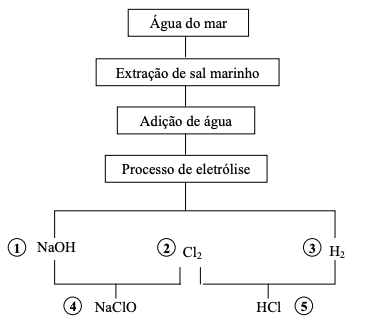
A partir dessas informações, analise as afirmativas.
I - O subproduto 1 da eletrólise é o hidróxido de sódio, conhecido como soda cáustica, matéria-prima utilizada na fabricação de sabão, detergentes e papel. II - Para obtenção de 36,5 g do subproduto 5 são necessários 0,5 mol de H2 e 0,5 mol de Cl2. III - A eletrólise ocorrida entre o sal marinho e a água é uma reação espontânea, sem necessidade de energia para a sua realização. IV - O subproduto 4 é utilizado para lavagem de roupas coloridas. V - O subproduto 3 é extremamente reativo e perigoso, utilizado na produção de amônia.
Estão corretas as afirmativas
KMnO4 (aq) +HF (aq) → KF (aq) + MnF2 (aq) + H2O (l) + F2 (g)
Balanceie a equação química e, baseando-se na equação balanceada, assinale a proposição correta acerca dos estados de oxidação das espécies químicas e da estequiometria da reação:
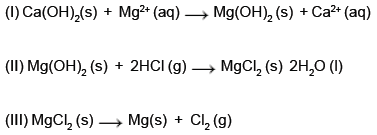
A partir das reações representadas e das propriedades dos elementos e substâncias, é correto afirmar:
 Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V 
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
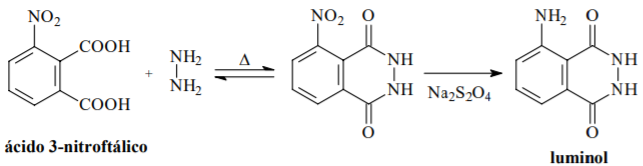
O Na2S2O4 atua como agente oxidante.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma pilha montada com cobre e prata possui equação global 2Ag+ + Cu ==> 2Ag + Cu2+.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma pilha montada nas condições padrão com os pares Zn2+/Zn e Cu2+/Cu terá o eletrodo de cobre metálico como polo negativo da pilha.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao mergulharmos um fio de cobre metálico em uma solução 1,0 mol/ℓ de íons Zn2+ a 25 °C e 1,0 atm, ocorrerá deposição espontânea de zinco sobre o fio de cobre.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao mergulharmos um fio de cobre metálico em uma solução de íons Ag+, nas condições padrão, ocorrerá deposição espontânea de prata sobre o fio de cobre.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma pilha montada nas condições padrão com os pares Zn2+/Zn e Ag+/Ag fornecerá uma f.e.m. de 2,36 V.