Questões de Vestibular
Sobre estudo da matéria: substâncias, misturas, processos de separação. em química
Foram encontradas 241 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Se o astrônomo utilizasse uma mistura de gases em seu balão, essa mistura poderia ser considerada como homogênea.
O vazamento de petróleo, proveniente de navios petroleiros, geralmente identificado pelas grandes manchas negras de óleo sobre a superfície dos mares e sobre a areia de praias da costa brasileira, vem causando danos irreparáveis à vida marinha.
A partir dessas informações, é correto afirmar:


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.
Considere a curva de aquecimento de uma substância sólida até seu estado gasoso, em função do tempo, à pressão de 1 atmosfera.
De acordo com as informações do enunciado e com o gráfico acima, assinale a proposição CORRETA.
A curva de aquecimento mostra que a substância não é pura, mas sim, uma mistura
homogênea simples.
Considere a curva de aquecimento de uma substância sólida até seu estado gasoso, em função do tempo, à pressão de 1 atmosfera.
De acordo com as informações do enunciado e com o gráfico acima, assinale a proposição CORRETA.
A temperatura T2 representa o ponto de ebulição da substância.
Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
o enxofre encontra-se em duas formas alotrópicas: o ortorrômbico e o monoclínico.
Vazamento de petróleo desafia a tecnologia no Golfo do México
Robôs, drenos e dispersantes são usados para tentar evitar desastre.
Quase um milhão de litros de óleo se espalham no mar por dia nos EUA.
Às 22h do dia 20 de abril houve uma explosão no Golfo do México. Onze funcionários da empresa British Petroleum ficaram desaparecidos no acidente. Desde então, formou-se uma corrida contra aquele que pode se tornar em breve o maior derramamento de óleo já ocorrido nos Estados Unidos, e um dos maiores da história – somando todas as manchas, a área é comparável ao tamanho de um país como Porto Rico.
Aviões jogam dispersantes sobre a mancha, perto de um milhão de litros até agora. É uma espécie de sabão... O óleo se dispersa na água e pode ser digerido por bactérias marinhas...
Disponível em:<http://www.g1.com/mundo/noticia/2010/05/vazamento-de-petroleo-desafia...> Acesso em: 10 ago. 2010. (Adaptado)
Uma rota para se obter sabão pode ser assim representada:
Com base no texto e no esquema acima, assinale a proposição CORRETA.
O petróleo é mais denso que a água do mar, por isso ele flutua e forma as manchas.
Vazamento de petróleo desafia a tecnologia no Golfo do México
Robôs, drenos e dispersantes são usados para tentar evitar desastre.
Quase um milhão de litros de óleo se espalham no mar por dia nos EUA.
Às 22h do dia 20 de abril houve uma explosão no Golfo do México. Onze funcionários da empresa British Petroleum ficaram desaparecidos no acidente. Desde então, formou-se uma corrida contra aquele que pode se tornar em breve o maior derramamento de óleo já ocorrido nos Estados Unidos, e um dos maiores da história – somando todas as manchas, a área é comparável ao tamanho de um país como Porto Rico.
Aviões jogam dispersantes sobre a mancha, perto de um milhão de litros até agora. É uma espécie de sabão... O óleo se dispersa na água e pode ser digerido por bactérias marinhas...
Disponível em:<http://www.g1.com/mundo/noticia/2010/05/vazamento-de-petroleo-desafia...> Acesso em: 10 ago. 2010. (Adaptado)
Uma rota para se obter sabão pode ser assim representada:
Com base no texto e no esquema acima, assinale a proposição CORRETA.
Uma mistura de óleo e água é homogênea.
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
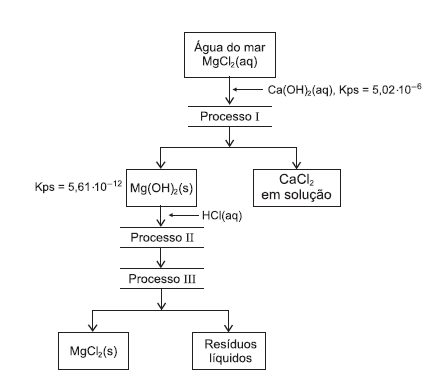
No processo Dow, de extração de magnésio, da água do mar, sob a forma de íons Mg2+(aq), representado pelo fluxograma, hidróxido de cálcio, Ca(OH)2(aq), é adicionado à água do mar, para que o Mg(OH)2(s) se precipite, permanecendo os íons Ca2+(aq) na fase aquosa. Após precipitação do cloreto de magnésio, MgCl2(s), produto final desse processo, esse sal é utilizado para produzir magnésio por eletrólise.
A partir da análise desse fluxograma e das informações do
texto, é correto afirmar:
A partir da concepção de Robert Boyle e do conceito moderno de elemento químico, é correto afirmar:
Observe as representações abaixo e assinale a alternativa correta.
Considerando as informações do texto, têm-se as seguintes afirmativas: I - O suor é uma mistura heterogênea do tipo suspensão. II - A densidade do suor é a razão entre seu volume e sua massa e representa uma propriedade química. III - O suor sobre a pele desaparece quando o atleta pára de jogar, porque retira energia térmica do corpo para transformar seu estado físico de líquido para gasoso. IV - Os íons sódio e potássio, contidos no suor, são metais alcalinos e pertencem ao primeiro grupo da tabela periódica. V - Os íons sódio, potássio e magnésio, liberados durante a transpiração, possuem cargas iguais a +1, +1 e +2, respectivamente.
Assinale a alternativa que reúne somente afirmativas corretas.
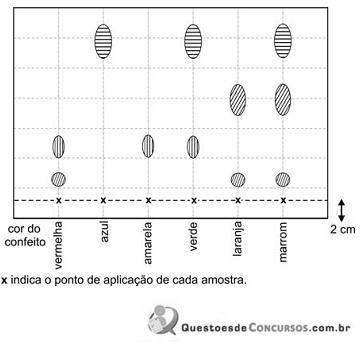
Os confeitos em cuja fabricação é empregado um corante amarelo são os de cor

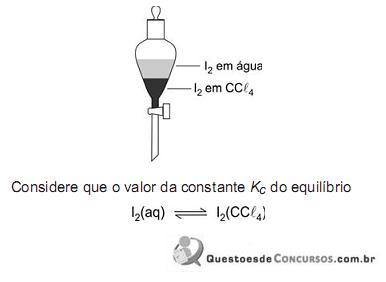
é igual a 100, à temperatura do experimento, para concentrações expressas em moI/L.
Assim sendo, o que é correto afirmar a respeito do sistema descrito?