Questões de Vestibular
Comentadas sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 80 questões
CH4(g) + 3 Cl2(g) → CHCl3(l) + 3 HCl(g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é
Texto base para a questão.
A Tiquira é um destilado de mandioca muito popular no Maranhão. Alguns consideram a Tiquira a verdadeira aguardente brasileira por ser feita da mandioca, uma planta nativa.
A aguardente tiquira – destilado produzido a partir do mosto fermentado de mandioca, originalmente incolor, adquire uma cor azulada, em razão da adição de folhas ou de flores de tangerina durante o processo de destilação. A obtenção do álcool, no processo de fermentação, ocorre conforme a reação química a seguir:
C6H12O6 → CO2 + CH3CH2OH
glicose etanol
Alguns produtores informais adicionam um corante chamado violeta de metila, conforme estrutura representada a seguir, que garante um vívido azul-arroxeado à bebida. Na Química, essa substância, é utilizada como um indicador para o intervalo de pH com valores de 0 a 1,6, quando apresenta uma coloração amarelada.
Considere os seguintes dados: C = 12 g.mol -1, H = 1 g.mol -1 e O = 16 g.mol -1.
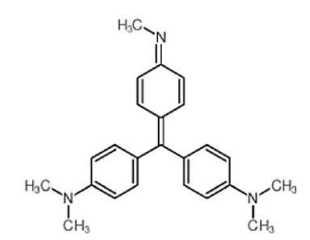
Estrutura química do indicador violeta de metila
Oxigênio (O2) e ozônio (O3) estão em constante processo de consumo e produção na estratosfera, como representado pelas equações químicas a seguir. As reações I e II ilustram etapas da produção de ozônio a partir de oxigênio, e a reação III mostra a restauração de oxigênio a partir de ozônio.
Reação ΔH (kcal/mol de O2)
I O2 → 2 O. −118
II 2 O2 + 2 O. → 2 O3 ΔHII
III 2 O3 → 3 O2 +21
Após o balanceamento da equação iônica, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
CS2 + H2S + Cu → Cu2S + CH4
Com base nessa informação, julgue o próximo item
Para que a reação apresentada seja balanceada, os coeficientes estequiométricos de seus componentes devem ser iguais a 1, 2, 8, 4 e 1, da esquerda para a direita.
O ácido tereftálico é um diácido carboxílico com fórmula molecular C8H6O4 , muito utilizado na produção de poliéster do tipo PET (polietilenotereftalato).
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Dados
MC = 12 g mol-1
MH = 1 g mol-1
MO = 16 g mol-1
Considere a equação da reação de combustão incompleta do gás butano:

A massa do gás monóxido de carbono (massa molar = 28 g/mol) formada quando 522 kg de gás butano (massa molar = 58 g/mol) sofrem combustão incompleta, numa reação com rendimento total, é de
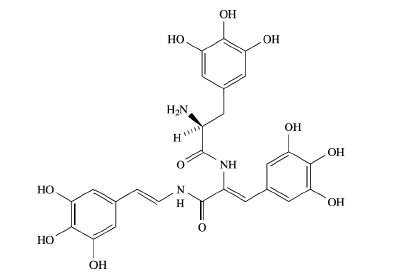
Acerca da estrutura do Tunicromo-B1, são realizadas algumas afirmações:
1) Em sua estrutura, são encontrados dois carbonos sp3.
2) A fórmula molecular do Tunicromo-B1 é C26H26O11N3.
3) São encontradas duas aminas secundárias e uma amina primária.
Está(ão) correta(s) a(s) afirmativa(s):
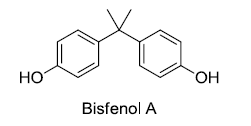
Acerca do bisfenol A, foram feitas algumas afirmações:
1) o bisfenol A é classificado como um composto aromático.
2) O bisfenol A apresenta apenas um carbono com hibridização sp3.
3) A fórmula molecular do bisfenol A é C15H16O2.
Está(ão) correta(s) a(s) afirmativa(s):
Considerando o composto orgânico C5H10O, analise os seguintes itens:
I.butanoato de metila;
II.pentan-2-ona;
III.ácido pentanóico;
IV.pentanal.
São compostos que podem ser escritos usando a fórmula química acima apresentada somente os que constam nos itens
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
Considere a reação entre o ácido ortofosfórico e o hidróxido de cálcio abaixo e assinale a alternativa correta que apresenta o composto X formado e o valor de n conforme a estequiometria da reação balanceada.
2H3PO4 + nCa(OH)2 → X + 6H2O
Leia o texto para responder a questão.
Em seu livro Tratado Elementar de Química, publicado em 1789, Antonie Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.
Nome antigo Nome proposto por Lavoisier Nome atual
ar vital oxigênio oxigênio
ar inflamável hidrogênio hidrogênio
ar fixo ácido carbônico dióxido de carbono
ácido vitriólico ácido sulfúrico ácido sulfúrico
vitríolo azul; vitríolo de cobre sulfato de cobre sulfato de cobre (II)
ácido marinho ácido muriático ácido clorídrico
sal marinho muriato de soda cloreto de sódio
soda aerada; soda efervescente carbonato de soda carbonato de sódio
Esse gás é o que, antigamente, era chamado de
Para a análise do teor de ozônio em um meio aquoso, utiliza-se iodeto de potássio e ácido sulfúrico. Esses compostos reagem conforme a seguinte equação:
x KI + O3 + H2 SO4 → y I2 + H2O + K2SO4
O TBT (M.M = 291 g/mol) é um composto polar, hidrofóbico e lipofílico que foi introduzido no mercado nos anos 40. É componente de tintas anti-incrustantes, utilizadas em cascos de barcos, redes e jaulas de aquacultura a fim de impedir a fixação de organismos como algas e invertebrados (mexilhão, cracas, etc.). Além disso, o TBT é utilizado também na agricultura como pesticida, conservante de madeiras e, numa escala menor, em desinfetantes e em tratamentos algicidas em materiais de construção. A sua elevada difusão no meio marinho tornou-se uma preocupação ambiental em nível mundial. Atualmente, é considerada a substância mais tóxica produzida pelo homem.
A composição centesimal do TBT é de 49.49% de Carbono, 9.62% de Hidrogênio e 40.89% de Estanho e sua fórmula molecular é:

