Questões de Vestibular de Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas
Foram encontradas 80 questões
Em motores de foguetes, ocorre a seguinte reação de hidrazina com peróxido de hidrogênio:
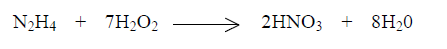
Para a produção de 630,1 gramas de ácido nítrico, são necessários quantos mols de hidrazina (N2H4)?
Leia o texto para responder a questão.
Em seu livro Tratado Elementar de Química, publicado em 1789, Antonie Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.
Nome antigo Nome proposto por Lavoisier Nome atual
ar vital oxigênio oxigênio
ar inflamável hidrogênio hidrogênio
ar fixo ácido carbônico dióxido de carbono
ácido vitriólico ácido sulfúrico ácido sulfúrico
vitríolo azul; vitríolo de cobre sulfato de cobre sulfato de cobre (II)
ácido marinho ácido muriático ácido clorídrico
sal marinho muriato de soda cloreto de sódio
soda aerada; soda efervescente carbonato de soda carbonato de sódio
Esse gás é o que, antigamente, era chamado de
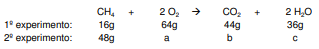
Para a análise do teor de ozônio em um meio aquoso, utiliza-se iodeto de potássio e ácido sulfúrico. Esses compostos reagem conforme a seguinte equação:
x KI + O3 + H2 SO4 → y I2 + H2O + K2SO4
O TBT (M.M = 291 g/mol) é um composto polar, hidrofóbico e lipofílico que foi introduzido no mercado nos anos 40. É componente de tintas anti-incrustantes, utilizadas em cascos de barcos, redes e jaulas de aquacultura a fim de impedir a fixação de organismos como algas e invertebrados (mexilhão, cracas, etc.). Além disso, o TBT é utilizado também na agricultura como pesticida, conservante de madeiras e, numa escala menor, em desinfetantes e em tratamentos algicidas em materiais de construção. A sua elevada difusão no meio marinho tornou-se uma preocupação ambiental em nível mundial. Atualmente, é considerada a substância mais tóxica produzida pelo homem.
A composição centesimal do TBT é de 49.49% de Carbono, 9.62% de Hidrogênio e 40.89% de Estanho e sua fórmula molecular é:
Medicamento é um produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico. A química orgânica é fundamental para o desenvolvimento de novos fármacos e o crescimento da indústria farmacêutica.
Dois dos princípios ativos de medicamentos mais
utilizados pelos brasileiros são ilustrados a seguir:
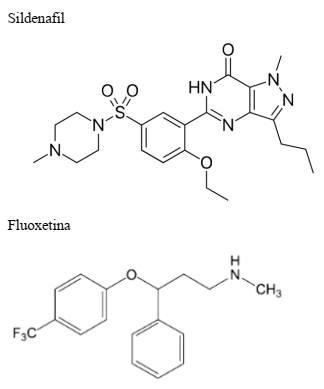
Em relação aos compostos apresentados, assinale a
alternativa CORRETA:
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
O dióxido de titânio, além de ser empregado como aditivo alimentar, é comumente usado para pigmentação branca em tintas, papel e plásticos. É também um ingrediente ativo, em protetores solares baseados em minerais, usado para a pigmentação com o objetivo de bloquear a luz ultravioleta. Além disso, o óxido também é usado em alguns chocolates para dar uma textura suave; em donuts, para fornecer cor; e em leites desnatados, para dar uma aparência mais brilhante, mais opaca, o que torna o produto mais saboroso.
Uma das reações utilizadas para a sua produção é a cloração de um mineral de titânio (ilmenita) cuja equação é a seguinte:
x FeTiO3 (s) + y Cl2 (g) + z C(s) → a FeCl2 (s) + bTiO2(s) + c CO2 (g)
Os números para os coeficientes x, y, z, a, b, c, que tornam
essa equação balanceada, são, respectivamente:
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
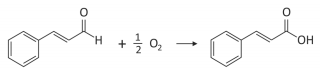
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
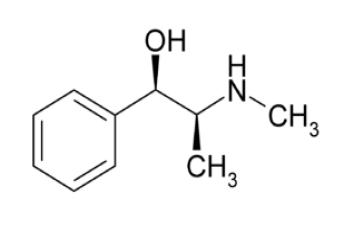 Com relação a essa molécula, podemos afirmar,
respectivamente, que sua fórmula molecular e os grupos
funcionais presentes correspondem às funções orgânicas:
Com relação a essa molécula, podemos afirmar,
respectivamente, que sua fórmula molecular e os grupos
funcionais presentes correspondem às funções orgânicas:Considere a representação tridimensional da molécula orgânica mostrada abaixo.
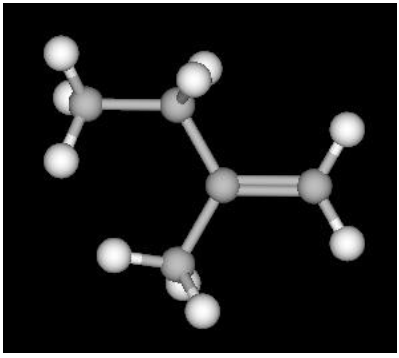
Sobre essa molécula, é correto afirmar que
Considerando as semirreações
BiO3- + 6H+ + 2e- → Bi3+ + 3H2O e Mn2+ + 4H2O → MnO4- + 8H+ + 5e- , é correto afirmar que o coeficiente do íon MnO4- na reação global devidamente balanceada é
A coniina é um alcaloide venenoso. Suas propriedades tóxicas eram conhecidas desde a antiguidade e já eram usadas na época dos gregos como um veneno para ser administrado àqueles condenados à morte.
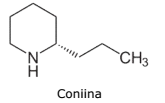
Atente ao que se diz a seguir sobre essa substância:
I. Contém carbono terciário.
II. É um composto aromático.
III. É um composto nitrogenado heterocíclico.
IV. Tem fórmula molecular C8H17N.
Está correto o que se afirma somente em
Considere as informações a seguir sobre a perfluorodecalina, substância utilizada no preparo de sangue artificial.
Fórmula mínima: C5 F9 .
Massa molar: 462 g/mol.
Sua fórmula molecular é representada por:
Na produção de sabão, uma amostra de 100 g de hidróxido de sódio reage com a estearina, de acordo com a reação não balanceada a seguir:
(C17H35COO)3C3 H5(s) + NaOH(aq) → C17H35COONa(s) + C3H5 (OH)3( l )
Considerando que, a partir de 100 g de hidróxido de
sódio, foram obtidos 512 g de estearato de sódio, o rendimento
deste procedimento é aproximadamente igual a
Um volume de 16.42 mL de uma solução de permanganato de potássio 0.1327 M é necessário para oxidar 20.00 mL de uma solução de FeSO4 em meio ácido.
Considere que a equação não balanceada representativa da reação é:
Fe2+ + MnO4 − + H+ → Mn2+ + Fe3+ + H2O
A concentração da solução do sal de ferro será
aproximadamente:



